
硫酸的工業制備是一個重要的化工生產過程,但同時在生產過程中會產生大量SO2等污染物。
(1)將SO2通入Fe(NO3)3溶液中,溶液由棕黃色變為淺綠色,但立即又變為棕黃色,此時若滴入BaCl2溶液,則會產生白色沉淀。溶液由棕黃色變為淺綠色用離子方程式表示為_____,后又由淺綠色變為棕黃色的離子方程式為_____。
(2)以硫酸工業的尾氣、氨水、石灰石、焦炭及碳酸氫銨和KCI為原料可以合成有重要用途的硫化鈣、硫酸鉀、亞硫酸氫銨等物質。合成路線如下: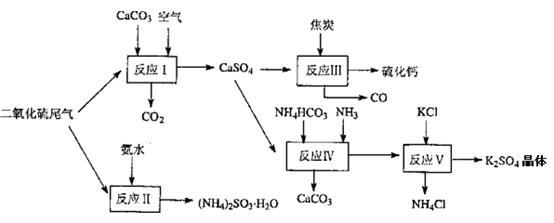
寫出反應反應Ⅳ的化學方程式 ;
反應III中氧化劑與還原劑的物質的量之比為__ __;
反應V在25'C、40%乙二醇溶液中進行,該復分解反應能順利進行的原因是 。
(3)新型納米材料氧缺位鐵酸鋅(ZnFe2Ox),常溫下能使SO2分解,減小工業廢氣對環境的影響,它由鐵酸鋅(ZnFe2O4)經高溫還原制得,轉化流程如下圖所示: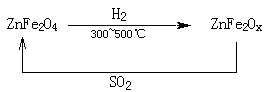
若2molZnFe2Ox與SO2反應可生成 0.75molS,x= ,寫出鐵酸鋅高溫下被還原生成氧缺位鐵酸鋅的化學方程式
(4)石灰石-石膏濕法煙氣脫硫工藝技術的原理是煙氣中的二氧化硫與漿液中的碳酸鈣以及空氣反應生成石膏(CaSO4.2H2O),寫出該反應的化學方程式 。某電廠用煤300t(煤中含硫的質量分數為2.5%),若燃燒時煤中的硫全部轉化為二氧化硫,用該方法脫硫時有96%的硫轉化為石膏,則可生產石膏 t。
(共16分)(1)SO2 + 2Fe3+ + 2H2O=SO42- + 2Fe2+ + 4H+(2分)
3Fe2+ + NO3- + 4H+=3Fe3+ + NO↑+ 2H2O(2分)
(2)NH4HCO3 + CaSO4 + NH3=CaCO3↓+ (NH4)2SO4 (2分) 1:4(1分)
K2SO4在乙二醇溶液中的溶解度小(1分)
(3)3.25(2分) 4ZnFe2O4 + 3H2 4ZnFe2O3.25 + 3H2O(2分)
4ZnFe2O3.25 + 3H2O(2分)
(4)2CaSO4 + 2SO2 + O2 + 4H2O=2(CaSO4.2H2O)+2CO2 (2分) 38.7(2分)
解析試題分析:(1)SO2具有還原性,鐵離子具有氧化性,鐵離子能把SO2氧化生成硫酸,而鐵離子被還原為亞鐵離子,所以溶液由棕黃色變為淺綠色,反應的離子方程式是SO2 + 2Fe3+ + 2H2O=SO42- + 2Fe2+ + 4H+。由于在酸性條件下,NO3-具有強氧化性,能把亞鐵離子氧化生成鐵離子,因此又由淺綠色變為棕黃色,反應的離子方程式為3Fe2+ + NO3- + 4H+=3Fe3+ + NO↑+ 2H2O。
(2)反應Ⅳ的反應物有硫酸鈣、碳酸氫銨和氨氣,生成物之一是碳酸鈣,則根據原子守恒可知,另外一種生成物是硫酸銨,因此反應的化學方程式是NH4HCO3 + CaSO4 + NH3=CaCO3↓+ (NH4)2SO4。反應Ⅲ中碳的化合價從0價升高到+2價,失去2個電子,發生氧化反應,碳是還原劑。S元素的化合價從+6價降低到-2價,得到8個電子,發生還原反應,即硫酸鈣是氧化劑。反應根據電子的得失守恒可知,在反應中氧化劑與還原劑的物質的量之比為1:4。由于K2SO4在乙二醇溶液中的溶解度小,能夠形成晶體而析出,因此符合復分解反應發生的條件。
(3)ZnFe2OX中Fe的平均價態為+(x-1),而在生成物中鐵的化合價是+3價,則鐵在反應中失去(3-x+1)個電子。而SO2→S 中S的化合價從+4價降低到0價,得到4個電子,所以根據電子的得失守恒可知,2mol×2×(3-x+1)=0.75×4,解得x=3.25。所以鐵酸鋅高溫下被還原生成氧缺位鐵酸鋅的化學方程式為4ZnFe2O4 + 3H2 4ZnFe2O3.25 + 3H2O。
4ZnFe2O3.25 + 3H2O。
(4)根據原子守恒可知,反應中還應該有CO2生成,因此反應的化學方程式是2CaSO4 + 2SO2 + O2 + 4H2O=2(CaSO4.2H2O)+2CO2 。據硫原子守恒可知:
S~~~~~~CaSO4·2H2O
32t 172t
300t·2.5%·96% m
解得m=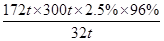 =38.7t
=38.7t
考點:考查SO2、硝酸以及鐵離子和亞鐵離子的性質;氧化還原反應方程式的書寫以及有關計算;反應條件的控制;根據方程式進行的有關計算等


科目:高中化學 來源: 題型:填空題
工業上生產硫酸時,利用催化氧化反應將SO2轉化為SO3是一個關鍵步驟。壓強及溫度對SO2轉化率的影響如下表(原料氣各成分的體積分數為:SO2 7%,O2 11%,N2 82%):
| 壓強/MPa 轉化率/% 溫度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(l)火法煉鋅是將閃鋅礦(主要成分是ZnS)通過浮選焙燒使它轉化為氧化鋅,再把氧化鋅和焦 炭混合,在鼓風爐中加熱到1100~1300℃,使鋅蒸餾出來。
①寫出火法煉鋅的主要反應:
焙燒反應: 。
鼓風爐中可能發生的反應: (任寫一個)
②從保護環境和充分利用原料角度看如何處理和利用產生的煙氣?
(2)工業上冶煉鋁就是電解氧化鋁
①冶煉鋁的電解槽中的陰極和陽極材料均用石油煉制和煤的干餾產品 (填物質名稱)
②氧化鋁的熔點很高,在鋁的冶煉中要加入冰晶石(Na3AlF),其作用是____ 。
③工業上冶煉鋁時用的原料是Al2O3,而不是AlCl3,其原因是 。
(3)工業上“聯合制堿法”中主要反應的化學方程式是 。其中的CO2來源于 。
(4)磁酸鈣是制玻璃的原料之一,工業上制玻璃是在玻璃熔爐中進行,其中反應之一為: ,若在上述條件下,把l000ag CaCO3和60ag SiO2混合,則生成的CO2在標準狀況下的體積為 (用含a的代數式表示)。
,若在上述條件下,把l000ag CaCO3和60ag SiO2混合,則生成的CO2在標準狀況下的體積為 (用含a的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
【化學與技術】
下圖表示某些化工生產的流程(有的反應條件和產物已略去)
請回答下列問題:
(1)流程中所涉及的化學工業 (寫出兩個即可)。
(2)反應I需在500℃進行,主要原因是 ;實際工業生產中,反應Ⅱ的條件是 。
(3)寫出反應III的化學方程式 。
(4)工業上,析出K后,再向母液中繼續通入E,并加入細小食鹽顆料,其目的是 。
(5)工業上常用Na2CO3溶液吸收制取HNO3產生的尾氣中的NO2,生成NaNO3、NaNO2和一種氣體,寫出反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
【化學與技術】
下圖是某企業設計的硫酸—磷肥—水泥聯產、海水—淡水多用、鹽—熱—電聯產的三大生態產業鏈流程圖。
根據上述產業流程回答下列問題:
(1)該流程①、②、③、④、⑤為能量或物質的輸送,請分別寫出輸送的主要物質的化學式或能量形式:① 、② 、③ 、④ 、⑤ 。
(2)沸騰爐發生反應的化學方程式 。磷肥廠的主要產品是普鈣(磷酸二氫鈣和硫酸鈣),寫出由磷礦石和硫酸反應制普鈣得化學方程式 。
(3)用1噸硫鐵礦(FeS2的質量分數為36%)接觸法制硫酸,制硫酸的產率為65%,則最后能生產出質量分數為98%的硫酸 噸。
(4)熱電廠的冷卻水是 ,該流程中濃縮鹽水除提取鹽以外還可提取的物質有 (寫出一種即可)。
(5)根據現代化工廠設計理念請提出高爐煉鐵廠廢氣、廢渣及多余熱能的利用設想。 , (寫出兩點即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
利用化學原理可以對工廠排放的廢水、廢渣等進行有效檢測與合理處理。某工廠對制革工業污泥中Cr(Ⅲ)的處理工藝流程如下。
其中硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)實驗室用18.4 mol·L-1的濃硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃儀器除燒杯、玻璃棒和量筒外,還需_______________________ _。
(2)酸浸時,為了提高浸取率可采取的措施有_____________________________
______________________________________________________(答出兩點)。
(3)H2O2的作用是將濾液Ⅰ中的Cr3+轉化為Cr2O72—,寫出此反應的離子方程式:_____________________________________________________________。
(4)常溫下,部分陽離子以氫氧化物形式沉淀時溶液的pH如下:
| 陽離子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 開始沉淀時的pH | 2.7 | - | - | - |
| 沉淀完全時的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列關于化工生產原理的幾種敘述中,均符合目前工業生產實際情況的是( )
| A.石油是烴的混合物,石油工業中采用干餾的方法把石油分成不同沸點范圍的產物 |
| B.氯氣和氫氣混合在光照條件下生成氯化氫,再用水吸收生成鹽酸 |
| C.二氧化硫在接觸室被氧化成三氧化硫,再在吸收塔內被水吸收制成濃硫酸 |
| D.合成氨工業中,由于氨易液化,N2、H2循環使用,所以總體來說氨的產率很高 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
研究氣體在固體表面反應的化學已經成為化學學科的一個重要分支,它涉及生產、生活中的許多重要領域。下列不屬于氣體與固體作用的表面化學研究領域的是( )。
| A.合成氨工業是將氮氣和氫氣在鐵催化劑的表面轉化成氨氣 |
| B.在燃料電池中,氫氣和氧化劑在催化劑表面反應所產生的能量轉化為電能 |
| C.汽車中裝有催化器,能將尾氣中一氧化碳和氮氧化物轉化為二氧化碳和氮氣 |
| D.加酶洗衣粉的乳化作用能將衣物纖維表面的油漬洗去 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com