
【題目】下表為元素周期表的一部分,用元素符號或化學式完成各小題。
IA | ⅡА | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ||||
4 | ② | ④ | ⑩ |
(1)化學性質最不活潑的元素__________________,非金屬性最強的元素是___________________。最穩定的氣態氫化物是___________________;最高價氧化物對應水化物酸性最強的是_____________________________________________。
(2)金屬性最強的單質與水反應的離子方程式為______________。
(3)③⑦⑧⑨四種元素的簡單離子半徑由大到小的順序為_________________。
(4)分別寫出⑥、⑦和氫形成的氣態氫化物的結構式___________________。
(5)用電子式表示②的氧化物的形成過程____________________________。
【答案】Ar F HF HClO4 2K+2H2O=2OH-+2K++H2↑ r(Cl-)>r(N3-)>r(F-)>r(Mg2+) ![]() 、
、![]()
![]()
![]()
![]()
【解析】
根據元素在周期表中的位置知,①~號元素分別是Na、K、Mg、Ca、Al、C、O、F、Cl、Br、Ar元素;據此解答。
(1)稀有氣體化學性質最不活潑,這幾種元素中,化學性質最不活潑的是Ar元素;非金屬性最強的元素位于周期表右上角(稀有氣體除外),所以這幾種元素中非金屬性最強的是F元素,最穩定的氣態氫化物為HF,因O、F無正價,則最高價氧化物對應水化物酸性最強的是HClO4;
(2)金屬性最強的單質是K,K與水反應生成KOH和氫氣,發生反應的離子方程式為2K+2H2O=2OH-+2K++H2↑;
(3)Cl-比O2-、F-和Mg2+多一個電子層,而O2-、F-和Mg2+的離子結構相同,核電荷數越大,離子半徑越小,則離子半徑由大到小的順序為r(Cl-)>r(N3-)>r(F-)>r(Mg2+);
(4)C和O與H形成的簡單氫化物為CH4和H2O,它們的結構式依次為![]() 、
、![]() ;
;
(5)K的氧化物為K2O,是離子化合物,用電子式表示其形成過程為![]()
![]()
![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】草酸是一種二元弱酸,可用作還原劑、沉淀劑等。某校課外小祖的同學設計利用C2H2氣體制取H2C2O42H2O。回答下列問題:
(1)甲組的同學以電石(主要成分CaC2,少量CaS及Ca3P2雜質等)為原料,并用如圖裝置制取C2H2。

①電石與水反應很快,為了減緩反應速率,裝置A中除用飽和食鹽水代替水之外,還可以采取的措施是____________________________ (寫一種即可)。
②裝置B中,NaClO將H2S、PH3 氧化為硫酸及磷酸,本身被還原為NaCl,其中PH3被氧化的離子方程式為________________________。
(2)乙組的同學根據文獻資料,用Hg(NO3)2作催化劑,濃硝酸氧化C2H2制取H2C2O4·2H2O。制備裝置如圖所示:

①裝置D中多孔球泡的作用是______________________。
②裝置D中生成H2C2O4的化學方程式為___________________________________。
③從裝置D中得到產品,還需經過__________________(填操作名稱)、過濾、洗滌及干燥。
(3)丙組設計了測定乙組產品中H2C2O4·2H2O的質量分數實驗。他們的實驗步驟如下:準確稱取m g產品于錐形瓶中,加入適量的蒸餾水溶解,再加入少量稀硫酸,然后用c mol/L酸性KMnO4標準溶液進行滴定至終點,共消耗標準溶液V mL。
①滴定時高錳酸鉀標準溶液盛放在滴定管中_____________(填“酸式”或“堿式”)。
②滴定過程中發現褪色速率開始很慢后逐漸加快,分析可能的原因是______________ 。
③產品中H2C2O4·2H2O的質量分數為_________________(列出含 m、c、V 的表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
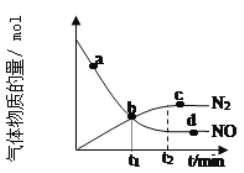
【題目】(1)氨氣可作為脫硝劑,在恒溫恒容密閉容器中充入一定量的NO和NH3,在一定條件下發生反應:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能說明該反應已達到平衡狀態的標志是___。
a.反應速率v(NH3)=v(N2)
b.容器內壓強不再隨時間而發生變化
c.容器內N2的物質的量分數不再隨時間而發生變化
d.容器內n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
e.12mol N-H鍵斷裂的同時生成5mol N≡N鍵
②某次實驗中測得容器內NO及N2的物質的量隨時間變化如圖所示,圖中b點對應的速率關系是v(正)___v(逆);d點對應的速率關系是v(正)___v(逆)。(填﹥、﹤或﹦)。
(2)一定條件下,在2L密閉容器內,反應2NO2(g)![]() N2O4(g),n(NO2)隨時間變化如下表:
N2O4(g),n(NO2)隨時間變化如下表:
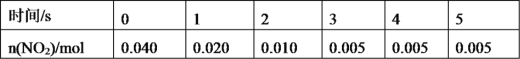
①用N2O4表示0~2s內該反應的平均速率為___。在第5s時,NO2的轉化率為___。
②根據上表可以看出,隨著反應進行,反應速率逐漸減小,其原因是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為研究硝酸的性質設計并完成如下實驗:
a、某興趣小組設計如圖所示裝置來改進教材中“銅與硝酸反應”實驗,以探究化學實驗的綠色化。

(1)實驗前,關閉活塞 b,試管 d 中加水至浸沒長導管口,塞緊試管 c 和 d 的膠塞,加熱 c,其目的是__________
(2)在 d 中加適量 NaOH 溶液,c 中放一小塊銅片,由分液漏斗 a 向 c 中加入2mL 濃硝酸,c 中反應的離子方程式___________________________________________;再由 a 向 c 中加 2mL 蒸餾水、寫出 c 中可能進行的兩個反應的化學方程式_______________________________________;________________________________________.
b、室溫下,將鐵片分別置于適量的稀 HNO3 和濃 HNO3 中(如圖所示)。

(1)氣球的作用是_____________________________________
(2)A中溶液最終變為淺綠色,發生反應的離子方程式是______________________
(3)B 中無明顯變化,該同學進一步探究如下:假設①常溫下鐵與濃硝酸不反應。②_______________________
進行實驗:將 B 中的鐵片取出并洗凈后,放入 CuSO4 溶液中,無明顯變化, 則說明假設①_____________(填“成立”或“不成立”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將銅片放入 115mL 某濃度的濃硫酸中,在加熱條件下反應,待銅片全部溶解后,將其溶液稀釋到500mL,再加入足量鋅粉,使之充分反應,收集到 2.24L(標準狀況下)氫氣。過濾殘留固體,干燥后稱量,質量減輕了 7.5g。求原硫酸的物質的量濃度________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據元素周期表和元素周期律,判斷下列敘述不正確的是

A. 氣態氫化物的穩定性:H2O>NH3>SiH4
B. 氫元素與其他元素可形成共價化合物或離子化合物
C. 上圖所示實驗可證明元素的非金屬性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118號元素在周期表中位于第七周期0族
”(ào)命名的第118號元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,回答相關的問題。
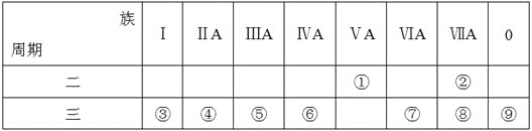
(1)寫出④的元素符號__。
(2)在這些元素中,最活潑的金屬元素與水反應的離子方程式:__。
(3)在這些元素中,最高價氧化物的水化物酸性最強的是__(填相應化學式,下同),堿性最強的是__。
(4)這些元素中(除⑨外),原子半徑最小的是__(填元素符號,下同),原子半徑最大的是__。
(5)②的單質與③的最高價氧化物的水化物的溶液反應,其產物之一是OX2,(O、X分別表示氧和②的元素符號,即OX2代表該化學式),該反應的離子方程式為(方程式中用具體元素符號表示)__。
(6)⑦的低價氧化物通入足量Ba(NO3)2溶液中的離子方程式__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗方案中,能達到相應實驗目的的是
A.方案①用于分離I2和NH4I固體
B.方案②用于比較CuSO4和MnO2的催化活性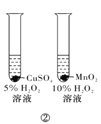
C.方案③用于測定中和熱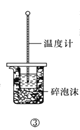
D.方案④用于比較醋酸和硼酸的酸性強弱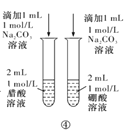
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】低碳經濟是指在可持續發展理念指導下,盡可能地減少煤炭、石油等高碳能源消耗,減少溫室氣體排放,達到經濟社會發展與生態環境保護雙贏的一種經濟發展形態。下列是有關碳元素的相關轉化,回答下列問題:
(1)已知甲醇是一種清潔燃料,制備甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃燒熱分別為H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g)![]() CH3OH(l) △H=________ kJ/mol。
CH3OH(l) △H=________ kJ/mol。
(2)一定溫度下,一定可以提高甲醇合成速率的措施有(______)
a.增大起始通入![]() 值
值
b.恒溫恒容,再通入氦氣
c.使用新型的高效正催化劑
d.將產生的甲醇及時移走
e.壓縮體積,増大壓強
(3)在恒溫恒容條件下,下列說法可以判定反應CO(g)+2H2(g) ![]() CH3OH(g)已經達到平衡狀態的是(______)
CH3OH(g)已經達到平衡狀態的是(______)
a.體系中碳氫單鍵數目不再改變
b.體系中n(CO):n(H2)不再改變
c.體系中壓強或者平均摩爾質量不再改變
d.單位時間內消耗氫氣和CH3OH的物質的量相等
(4)在恒壓的容器中,曲線X、Y、Z分別表示在T1°C、T2°C和T3°C三種溫度下合成甲醇氣體的過程。控制不同的原料投料比,CO的平衝轉化率如圖所示:
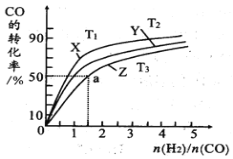
①溫度T1°C、T2°C和T3°C由高到低的順序為:_________________;
②若溫度為T3°C時,體系壓強保持50aMPa,起始反應物投料比n(H2)/n(CO)=1.5,則平衡時CO和CH3OH的分壓之比為__________,該反應的壓強平衡常數Kp的計算式為__________。(Kp生成物分壓冪的乘積與反應物分壓冪的乘積的比值,某物質的分壓等于總壓強×該物質的物質的量分數)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com