
(12分)【化學——化學與技術】
資源開發、材料制備及工農業生產等都離不開化學。請回答下列問題:
(1)工業制肥皂時,在皂化反應結束后需要在混合物中加入飽和食鹽水。加入飽和食鹽水的目的是 。
(2)Al2O3的熔點高達2050oC,工業上為了降低能量消耗,在金屬鋁的冶煉中通常采取的措施是 。
(3)工業上合成氨所需的氮氣來源于 ,氫氣來源于 ,寫出工業上在催化劑作用下制取氫氣的其中一個化學方程式 。
(4)工業制硫酸時,SO3的生成是在 (填設備名稱)中進行的,工業上常采用濃硫酸吸收SO3,而不直接用水吸收的原因是 。在吸收塔中,為提高SO3的吸收率所采取的措施為 。
(1)鹽析,使肥皂從混合液中分離出來。(2)在氧化鋁中加入冰晶石,降低混合物的熔點。(3)空氣,水和碳氫化合物,CH4+H2O CO+H2或CH4+2H2O
CO+H2或CH4+2H2O CO2+2H2。(4)接觸室,防止形成酸霧,影響SO3的吸收效率。從塔的下部通入SO3,從塔上部淋灑濃H2SO4,SO3和濃H2SO4在填料表面接觸而被吸收。
CO2+2H2。(4)接觸室,防止形成酸霧,影響SO3的吸收效率。從塔的下部通入SO3,從塔上部淋灑濃H2SO4,SO3和濃H2SO4在填料表面接觸而被吸收。
解析試題分析: (1)工業制肥皂時,加入飽和食鹽水的目的是鹽析,使肥皂從混合液中分離出來。(2)Al2O3的熔點高達2050oC,工業上為了降低能量消耗,在金屬鋁的冶煉中通常采取的措施是在氧化鋁中加入冰晶石,降低混合物的熔點。(3)工業上合成氨所需的氮氣來源于空氣,氫氣來源于水和碳氫化合物,工業上在催化劑作用下制取氫氣的化學方程式為CH4+H2O CO+H2或CH4+2H2O
CO+H2或CH4+2H2O CO2+2H2。(4)工業制硫酸時,SO3的生成是在接觸室中進行的,工業上常采用濃硫酸吸收SO3,而不直接用水吸收的原因是防止形成酸霧,影響SO3的吸收效率。在吸收塔中,為提高SO3的吸收率所采取的措施為從塔的下部通入SO3,從塔上部淋灑濃H2SO4,SO3和濃H2SO4在填料表面接觸而被吸收。
CO2+2H2。(4)工業制硫酸時,SO3的生成是在接觸室中進行的,工業上常采用濃硫酸吸收SO3,而不直接用水吸收的原因是防止形成酸霧,影響SO3的吸收效率。在吸收塔中,為提高SO3的吸收率所采取的措施為從塔的下部通入SO3,從塔上部淋灑濃H2SO4,SO3和濃H2SO4在填料表面接觸而被吸收。
考點:考查化學與技術,涉及肥皂的制取、鋁的冶煉、合成氨及硫酸工業。


科目:高中化學 來源: 題型:填空題
[化學—選修2化學與技術](15分)
(1)下列關于工業生產說法正確的是 。(填序號)
| A.在侯氏制堿工業中,向飽和氯化鈉溶液中先通二氧化碳,后通氨氣 |
| B.在硫酸工業、合成氨工業、硝酸工業中,皆采用循環操作提高原料利用率 |
| C.在氯堿工業,電解槽被離子交換膜隔成陰極室和陽極室 |
| D.工業上采用電解熔融氯化鋁的方法制取金屬鋁 |
| pH | Ca2+ 、Mg2+總濃度 | 細菌總數 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100個·mL-1? |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
地球的海水總量約有1.4×1018t,是人類最大的資源庫。
(1)如圖利用海水得到淡水的方法為 。
(2)電滲析法是近年發展起來的一種較好的海水淡化技術,其原理如下圖。a是電源的 極;Ⅰ口排出的是 (填“淡水” 或“濃水”)。
(3)海水淡化后的濃水中含大量鹽分(主要含有Mg2+、Ca2+、Fe3+和SO42-),排入水中會改變水質,排到土壤中會導致土壤鹽堿化,故不能直接排放,可以與氯堿工業聯產。
電解前需要把濃水精制,所需試劑主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是 。
(4)鈾是核反應最重要的燃料,其提煉技術直接關系著一個國家核工業或核武器的發展水平,海水中鈾以UCl4形式存在(以離子形式存在),每噸海水只含3.3毫克鈾,海水總量極大,鈾總量相當巨大。不少國家正在探索海水提鈾的方法。現在,已經研制成功一種螯合型離子交換樹脂,它專門吸附海水中的鈾,而不吸附其他元素。其反應原理為:___________________________(樹脂用HR代替),發生離子交換后的離子交換膜用酸處理還可再生并得到含鈾的溶液,其反應原理為:________________________。
(5)離子交換樹脂法是制備純水(去離子水) 的主要方法。某陽離子交換樹酯的局部結構可寫成(如圖)。該陽離子交換樹脂是由單體苯乙烯和交聯劑對二乙烯基苯聚合后再經 反應得到的。自來水與該離子交換樹脂交換作用后顯 (填“酸性”、“堿性”或“中性”)。
(6)中國《生活用水衛生標準》中規定,水的總硬度不能過大。如果硬度過大,飲用后對人體健康與日常生活有一定影響。暫時硬水的硬度是由 (填陰離子符號)引起的,經 (填操作名稱)后可被去掉。永久硬水的硬度可由離子交換法去掉。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ.工業上用鋁土礦制取鋁的流程如下: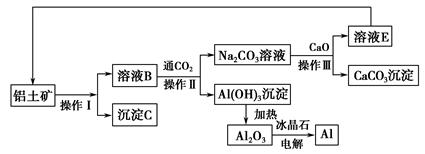
請回答下列問題:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃儀器有__________________________。
(2)寫出由溶液B生成Al(OH)3的離子方程式:____________________________。
(3)工藝流程中涉及氧化還原反應的化學方程式為:_________________________。
(4)生產過程中,除NaOH、H2O可以循環使用外,還可以循環使用的物質有________(填化學式)。用此法制取鋁的副產品是________(填化學式)。
Ⅱ.我國高爐生產各方面取得了顯著進步,但在資源和能源利用率、高爐大型化、提高產業集中度以及環保等方面還跟國際存在很大差距,有待進一步提高,努力向鋼鐵強國邁進。請回答下列問題:
(1)高爐煉鐵的原料有鐵礦、焦炭和石灰石,其中起熔劑作用的是________,目的是除去鐵礦石中的脈石,其產物密度比鐵________,所以在鐵水的________(填“上部”或“下部”)形成爐渣而與鐵水分離。
(2)焦炭在高爐煉鐵中起著舉足輕重的作用,下列不屬于焦炭作用的是________。
A.作為燃料,為煉鐵中的化學反應提供能量
B.作為還原劑與二氧化碳反應產生還原氧化鐵的一氧化碳
C.對高爐中的物料起到支撐和疏散的作用
D.作為溶劑,除去鐵礦石中的雜質
(3)高爐煉鐵的污染非常嚴重,目前我國部分大城市中的鋼鐵廠借著搬遷的機會也在進行著工藝改進。高爐煉鐵導致的環境污染有________。
A.臭氧空洞 B.酸雨 C.一氧化碳毒害 D.沙塵暴
(4)寫出高爐煉鐵中與碳元素有關的氧化還原反應化學方程式:____________________________。
(5)從“三廢”利用、環境保護等角度考慮,鋼鐵企業在生產中應采取的一些措施有(舉出2種措施即可) _______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
我國有豐富的天然氣資源。以天然氣為原料合成尿素的主要步驟如圖所示(圖中某些轉化步驟及生成物未列出):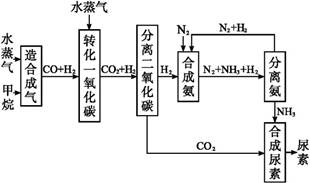
請填寫下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸氣在t℃、p kPa時,完全反應生成一氧化碳和氫氣(合成氣),吸收了a kJ熱量。該反應的熱化學方程式是 。
(2)上述流程中,工業上分離H2、CO2合理的方法是 。
| A.混合氣先通入氫氧化鈉溶液,再在溶液中加入鹽酸 |
| B.混合氣加壓冷卻,使CO2液化 |
| C.混合氣用氨水洗滌 |
| D.混合氣先通入石灰漿中,然后高溫煅燒固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
隨著材料科學的發展,金屬釩及其化合物得到了越來越廣泛的應用,并被譽為“合金維生素”。工業上回收廢釩催化劑(含有V2O5、VOSO4、K2SO4、SiO2)中釩的主要流程如下: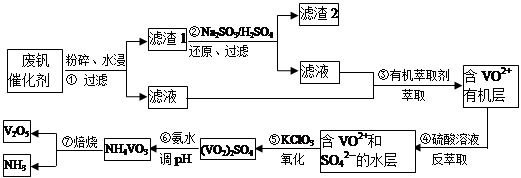
已知:(1)V2O5和NH4VO3均為難溶物,VOSO4和(VO2)2SO4均為易溶物。
(2) 2VO2++H2C2O4+2H+ = 2VO2+ + 2CO2↑+ 2H2O
回答下列問題:
(1)步驟①前,粉碎的目的是_________________________。
(2)步驟②中發生反應的離子方程式為__________________________。
(3)步驟③的變化過程可簡化為(HA表示有機萃取劑):
VOSO4 (水層)+ 2HA(有機層) VOA2(有機層)+ H2SO4(水層),則步驟④中可選擇硫酸作反萃取的原因是_____________。
VOA2(有機層)+ H2SO4(水層),則步驟④中可選擇硫酸作反萃取的原因是_____________。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以測定操作⑤后溶液中含釩量的步驟為:取10.0mL0.1mol/LH2C2O4溶液于錐形瓶中,加入指標劑,將待測液盛放在滴定管中,滴定到終點時,消耗待測液的體積為10.0mL,由此可知(VO2)2SO4溶液釩元素的含量為_________g/L。
(5)V2O5可用金屬(如Ca、Al)熱還原法獲得釩,則金屬鋁熱還原制得釩的化學方程式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
焦亞硫酸鈉(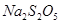 )常用作食品漂白劑,其制備工藝流程如下:
)常用作食品漂白劑,其制備工藝流程如下: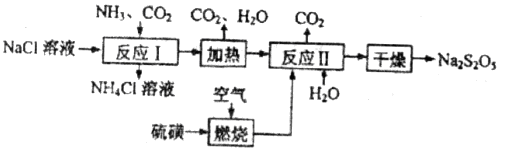
已知:反應Ⅱ包含 等多步反應。
等多步反應。
(1)反應Ⅰ的化學方程式為____________,反應Ⅰ進行時應先通入__________氣體。
(2)硫磺燃燒前先加熱成液態并通過噴嘴噴入焚硫爐中,目的是__________。在上述工藝流程中可循環使用的物質是_____________。
(3)反應Ⅱ中需控制參加反應的氣體與固體的物質的量之比接近____________,若氣體量不足,則會導致_______________。
(4)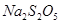 與稀硫酸反應放出
與稀硫酸反應放出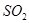 ,其離子方程式為___________。
,其離子方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上用閃鋅礦(主要成分為ZnS,還含有CdS、Fe2O3等雜質)為原料生產ZnSO4·7H2O的工藝流程如下:(己知Cd的金屬活動性介于Zn和Fe之間)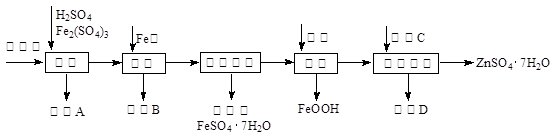
(1)從濾渣A中可獲得一種淡黃色非金屬單質的副產品,其化學式為 。
(2)浸取過程中Fe2(SO4)3的作用是 ,浸取時Fe2(SO4)3與ZnS發生反應的化學方程式為 。
(3)除鐵過程控制溶液的pH在5.4左右,該反應的離子方程式為 。該過程在空氣入口處設計了一個類似淋浴噴頭的裝置,其目的是 。
(4)置換法除重金屬離子是Cd2+,所用物質C為 。
(5)硫酸鋅的溶解度與溫度之間的關系如下表:
| 溫度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
我國及美國、日本等國家都已研制出一種陶瓷柴油機,這種柴油機的發動機部件的受熱面是用一種耐高溫且不易傳熱的材料來制造的,這種材料是( )。
| A.氧化鋁陶瓷 | B.氮化硅陶瓷 |
| C.光導纖維 | D.玻璃鋼 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com