
【題目】X、Y、Z、W、Q、R 是周期表中前 36 號元素,核電荷數依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 為非金屬元素,且 X 原子的核外成對電子數是未成對電子數的 2 倍,Z 的次外層電子數是最外層電子數的![]() ,W 原子的 s 電子與 p 電子數相等,Q 是前四周期中電負性最小的元素,R 的原子序數為 29。 回答下列問題:
,W 原子的 s 電子與 p 電子數相等,Q 是前四周期中電負性最小的元素,R 的原子序數為 29。 回答下列問題:
(1)X的最高價氧化物對應的水化物分子中,中心原子采取______________雜化。
(2)化合物 XZ 與 Y 的單質分子互為______________,1mol XZ 中含有π鍵的數目為______________。
(3)W 的穩定離子核外有______________種運動狀態的電子。W元素的第一電離能比其同周期 相鄰元素的第一電離能高,其原因是:_____。
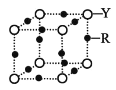
(4)Q 的晶體結構如圖所示,則在單位晶胞中 Q 原子的個數為______________,晶體的配位數是______________。

(5)R元素的基態原子的核外電子排布式為________;Y 與 R 形成某 種化合物的晶胞結構如圖所示,已知該晶體的密度為ρg·cm-3,阿伏加德羅常數的數值為 NA,則該晶體中 R 原子和 Y 原子之間的最短距離為______________cm。(只寫計算式)
【答案】sp2 等電子體 2NA 10 Mg 原子的價電子排布式為 3s2,3s 軌道處于全滿狀態,比較穩定, 失去一個電子比較困難 2 8 1s22s22p63s23p63d104s1 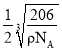
【解析】
X、Y、Z、W、Q、R 是周期表中前 36 號元素,核電荷數依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 為非金屬元素,且 X 原子的核外成對電子數是未成對電子數的 2 倍,則X的核外電子排布式為1s22s22p2,則X為碳;Z 的次外層電子數是最外層電子數的![]() ,則Z為氧,Y為氮;W 原子的 s 電子與 p 電子數相等,則W的核外電子排布式為1s22s22p63s2,W為鎂;Q 是前四周期中電負性最小的元素,則Q為鉀;R 的原子序數為 29,則R為銅,據此分析解答。
,則Z為氧,Y為氮;W 原子的 s 電子與 p 電子數相等,則W的核外電子排布式為1s22s22p63s2,W為鎂;Q 是前四周期中電負性最小的元素,則Q為鉀;R 的原子序數為 29,則R為銅,據此分析解答。
(1)X的最高價氧化物對應的水化物為H2CO3,結構式為 ,則中心原子C采取sp2雜化,故答案為:sp2;
,則中心原子C采取sp2雜化,故答案為:sp2;
(2)化合物CO與N2分子具有相同的原子個數及價層電子數,屬于等電子體;CO的結構與N2相似,為![]() ,其中含有π鍵的數目為2NA,故答案為:等電子體;2NA;
,其中含有π鍵的數目為2NA,故答案為:等電子體;2NA;
(3)Mg2+核外有10個電子,則有10種運動狀態的電子;W元素的第一電離能比其同周期相鄰元素的第一電離能高,其原因是Mg 原子的價電子排布式為 3s2,3s 軌道處于全滿狀態,比較穩定,失去一個電子比較困難;故答案為:10;Mg 原子的價電子排布式為 3s2,3s 軌道處于全滿狀態,比較穩定,失去一個電子比較困難;
(4)根據晶胞結構知,鉀原子在頂點和體心,則在單位晶胞中鉀原子的個數為8×![]() +1=2;離體心鉀原子最近的鉀原子處于晶胞的8個頂點,則晶體的配位數是8;故答案為:2;8
+1=2;離體心鉀原子最近的鉀原子處于晶胞的8個頂點,則晶體的配位數是8;故答案為:2;8
(5)銅基態原子的核外電子排布式為1s22s22p63s23p63d104s1;晶胞中含有N原子數為:8×![]() =1,含有的Cu原子數為:12×
=1,含有的Cu原子數為:12×![]() =3,則晶胞的質量為
=3,則晶胞的質量為![]() ,設晶胞的棱長為d,則d3=
,設晶胞的棱長為d,則d3=![]() ,則R原子和Y原子之間的最短距離為
,則R原子和Y原子之間的最短距離為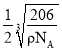 ;故答案為:1s22s22p63s23p63d104s1;
;故答案為:1s22s22p63s23p63d104s1;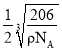 。
。


科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是
A.氯化鋁溶液中加入過量氨水:Al3++4OH-=![]() +2H2O
+2H2O
B.氫氧化鋇溶液與稀硫酸反應:Ba2++![]() =BaSO4↓
=BaSO4↓
C.碳酸鈣與鹽酸反應:![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
D.金屬鈉與水反應:2Na+2H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】自然界水體中的碳元素主要以碳酸鹽、碳酸氫鹽和有機物形式存在。水體中有機物含量是水質的重要指標,常用總有機碳衡量(總有機碳=![]() )。
)。
某學生興趣小組用如下實驗方法測定采集水樣的總有機碳。

步驟1:量取50 mL水樣,加入足量硫酸,加熱,通N2,并維持一段時間(裝置見右圖,夾持類儀器省略)。
步驟2:再向水樣中加入過量的K2Cr2O7溶液(可將有機物中的碳元素氧化成CO2),加熱,充分反應,生成的CO2完全被100 mL 0.205 mol·L-1的Ba(OH)2溶液吸收。
步驟3:將吸收CO2后的濁液過濾并洗滌沉淀,再將洗滌得到的濾液與原濾液合并,加水配制成500 mL溶液。量取25.00 mL溶液于錐形瓶中,加入指示劑,并滴加0.050 00 mol·L-1的H2C2O4溶液,發生反應:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O,恰好完全反應時,共消耗H2C2O4溶液20.00 mL。
(1)步驟1的目的是________。
(2)計算水樣的總有機碳(以mg·L-1表示),并寫出計算過程。____________
(3)用上述實驗方法測定的水樣總有機碳一般低于實際值,其原因可能是__________________________________________。
(4)高溫燃燒可將水樣中的碳酸鹽、碳酸氧鹽和有機物所含碳元素轉化為CO2,結合高溫燃燒的方法,改進上述實驗。
①請補充完整改進后的實驗方案:取V L的水樣,分為兩等份;將其中一份水樣高溫燃燒,測定生成CO2的物質的量為n1 mol;____________________________________,測定生成CO2的物質的量為n2 mol。
②利用實驗數據計算,所取水樣的總有機碳為________mg·L-1(用含字母的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】自然界的氮循環如下圖所示,下列說法不正確的是( )

A.①中N2與O2反應生成NO
B.②中合成氨屬于人工固氮
C.③中氮元素只被氧化
D.氧元素參與了氮循環
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】今年是門捷列夫發現元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z為短周期主族元素,W與X的最高化合價之和為8。下列說法錯誤的是

A. 原子半徑:W<X
B. 常溫常壓下,Y單質為固態
C. 氣態氫化物熱穩定性:Z<W
D. X的最高價氧化物的水化物是強堿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘循環工藝不僅能吸收SO2降低環境污染,同時又能制得氫氣,具體流程如下:
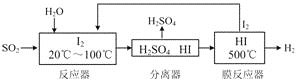
下列說法正確的是
A. 分離器中物質分離的操作為過濾
B. 該工藝中I2和HI的相互轉化體現了“碘循環”
C. 反應器和膜反應器中分別發生了非氧化還原反應和氧化還原反應
D. 碘循環工藝的總反應為2SO2 + 4H2O + I2 == H2+ 2H2SO4+ 2HI
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組性質比較中,正確的是()
①沸點:![]()
②離子還原性:![]()
③酸性:![]()
④金屬性:![]()
⑤氣態氫化物穩定性:![]()
⑥半徑:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】于固定體積的密閉容器中進行的氣體反應A(g)+B(g) ![]() C(s)+2D(g),可以說明在恒溫下已達到平衡狀態的是
C(s)+2D(g),可以說明在恒溫下已達到平衡狀態的是
①反應容器中壓強不隨時間變化而變化 ②A氣體和B氣體的生成速率相等 ③混合氣體的平均摩爾質量不隨時間變化而變化 ④反應混合氣體的密度不隨時間變化而變化
A. ③④B. ②③C. ①③D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂—次氯酸鹽電池的工作原理如圖,該電池反應為:Mg+ClO-+H2O=Mg(OH)2+Cl-。下列有關說法正確的是( )
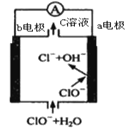
A.電池工作時,正極a附近的pH將不斷增大
B.電池工作時,c溶液中的溶質是MgCl2
C.負極反應式:ClO-+2e-+H2O=Cl-+2OH-
D.a電極發生還原反應,每轉移0.2mol電子,理論上生成0.2molCl-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com