
【題目】下列說法中正確的是
A. sp3雜化軌道是由任意的1個s軌道和3個p軌道混合形成的四個sp3雜化軌道
B. 乙炔分子中,每個碳原子都有兩個未雜化的2p軌道形成π鍵
C. 凡中心原子采取sp2雜化的分子,其分子構型都是平面三角形
D. 凡AB2型的共價化合物,其中心原子A均采用sp雜化軌道成鍵
【答案】B
【解析】試題分析:A.sp3雜化軌道是指同一電子層內,1個s軌道和3個p軌道雜化,形成能量相等的四個sp3雜化軌道,故A錯誤;B.乙炔分子的結構式H-C≡C-H,中心原子碳原子價層電子對個數=σ鍵個數+孤電子對個數=2+![]() ×(4-2×2)=2,采取sp雜化,每個碳原子都有兩個未雜化的2p軌道形成π鍵,故B正確;C.中心原子采取sp2雜化的分子,n=3,sp2雜化,不含孤電子對其分子構型都是平面三角形,否則不是,如二氧化硫分子中,價層電子對數=2+
×(4-2×2)=2,采取sp雜化,每個碳原子都有兩個未雜化的2p軌道形成π鍵,故B正確;C.中心原子采取sp2雜化的分子,n=3,sp2雜化,不含孤電子對其分子構型都是平面三角形,否則不是,如二氧化硫分子中,價層電子對數=2+![]() ×(6-2×2)=3,所以采取sp2雜化,含有一對孤電子對,所以立體構型為V型,故C錯誤;D.AB2型的共價化合物,其中心原子A價層電子對為2,則中心原子以sp雜化軌道成鍵,如氯化鈹分子中,鈹原子含有兩個共價單鍵,不含孤電子對,所以價層電子對數是2,中心原子以sp雜化軌道成鍵,AB2型的共價化合物,也有不采用sp雜化軌道成鍵,如二氧化硫分子中,價層電子對數=2+
×(6-2×2)=3,所以采取sp2雜化,含有一對孤電子對,所以立體構型為V型,故C錯誤;D.AB2型的共價化合物,其中心原子A價層電子對為2,則中心原子以sp雜化軌道成鍵,如氯化鈹分子中,鈹原子含有兩個共價單鍵,不含孤電子對,所以價層電子對數是2,中心原子以sp雜化軌道成鍵,AB2型的共價化合物,也有不采用sp雜化軌道成鍵,如二氧化硫分子中,價層電子對數=2+![]() ×(6-2×2)=3,所以采取sp2雜化,故D錯誤;故選B。
×(6-2×2)=3,所以采取sp2雜化,故D錯誤;故選B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,測得兩種金屬離子的PC與pH的變化關系如下圖所示。下列說法正確的是

A. 加入氨水調節pH可除去MgS04溶液中的CuSO4雜質
B. pH調到Q點則Mg2+和Cu2+都已沉淀完全
C. 在濃度均為1mo/LCuSO4和MgS04的混合溶液中,存在c(Cu2+)+c(Mg2+)>c(S042-)
D. L1代表pC(Cu2+)隨pH變化,L2代表pC(Mg2+)隨pH變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
①標準狀況下,0.2 mol任何物質的體積均為4.48 L ②若1 mol氣體的體積為22.4 L,則它一定處于標準狀況下 ③標準狀況下,1 L HCl和1 L H2O的物質的量相同 ④標準狀況下,1 g H2和14 g N2的體積相同 ⑤28 g CO的體積為22.4 L ⑥兩種物質的物質的量相同,則它們在標準狀況下的體積也相同 ⑦在同溫同體積時,氣體物質的物質的量越大,則壓強越大 ⑧同溫同壓下,氣體的密度與氣體的相對分子質量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ⑤⑥⑦⑧ D. ④⑦⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】美國馬丁·卡普拉等三位科學家因在開發多尺度復雜化學系統模型方面所做的貢獻,而獲得了諾貝爾化學獎。他們模擬出了1,6—二苯基—1,3,5—己三烯的分子模型,其結構簡式如圖所示。下列說法正確的是

A. 該有機物屬于芳香烴,與苯互為同系物
B. 該有機物的分子式為C18H18
C. 1mol 該有機物在常溫下最多能與6 mol Br2發生加成反應
D. 該有機物可以發生氧化反應、取代反應、加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳跟濃硫酸共熱產生的混合氣體X和銅跟濃硝酸反應產生的混合氣體Y同時通入盛有足量氯化鋇溶液的洗氣瓶中(如圖),下列說法正確的是( )

A. 洗氣瓶中產生的沉淀是BaCO3
B. 在Z導管出來的氣體中無CO2
C. 洗氣瓶中產生的沉淀是BaSO3
D. 在Z導管口有紅棕色氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋植物如海帶、海藻中含有大量的碘元素,碘元素以碘化鉀(即碘離子)的形式存在。實驗室里從海藻中提取碘的流程如下圖,已知 (Cl2+2KI=2KCl+I2)
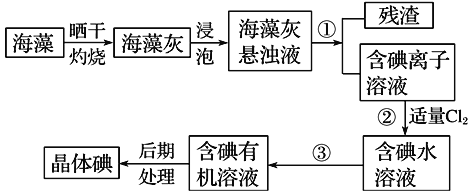
(1)實驗室焙燒海帶,需要下列儀器中的________(填字母)。
a.試管 b.燒杯c.坩堝 d.泥三角 e.三腳架 f.酒精燈
(2)指出提取碘的過程中有關的實驗操作名稱:①________,③__________。
(3)提取碘的過程中,可選擇的有機試劑是________。
A.苯、酒精 B.四氯化碳、苯 C.汽油、醋酸 D.汽油、酒精
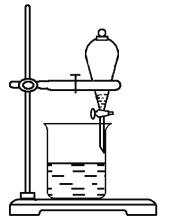
(4)某小組用CCl4萃取碘水中的碘,在如圖的分液漏斗中,下層液體呈______色;他們打開分液漏斗活塞,卻未見液體流下,原因可能是___________________ 。
(5)從含碘的有機溶液中提取碘和回收有機溶劑,還須經過蒸餾,指出下面實驗裝置圖中的錯誤之處:
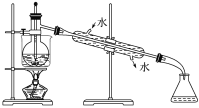
①________________________________________________;
②______________________________________________________;
③________________________________________________________。
(6)進行上述蒸餾操作時,使用水浴加熱的目的_______________________,最后晶態碘在________里聚集。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】采用下列裝置欲驗證CaSO4與炭粉受熱發生氧化還原反應,且還原產物是SO2。下列有關說法不正確的是
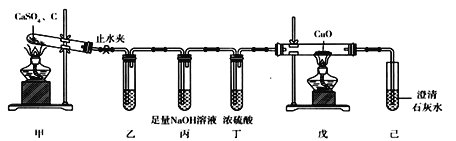
A. 裝置乙欲驗證氣體中的還原產物,故乙中盛有CaSO4溶液
B. 裝置丙和裝置丁的作用是除去SO2和其他雜質氣體
C. 裝置戊中黑色粉末變紅,己中出現白色沉淀,說明氧化產物有CO
D. 實驗結束時,應該先關閉止水夾,再迅速熄滅裝置甲中的酒精燈
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在恒容密閉容器中發生如下反應:2A(g)+B(g) 3C(g),若反應開始時充入2 mol A和2 mol B,達平衡后A的體積分數為a%。其他條件不變時,若按下列四種配比作為起始物質,平衡后A的體積分數大于a%的是( )
A. 1 mol B和3 mol C
B. 2 mol A、1mol B和1 mol He(不參加反應)
C. 1 mol B和1 mol C
D. 2 mol A、3mol B和3 mol C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數值下列有關敘述正確的是
A. 常溫常壓下, 30 g乙烷中所含的極性共價鍵數為6NA
B. 0.1mol Fe與足量鹽酸反應,轉移的電子數為0.3NA
C. 0.1 mol![]() Sr原子中含中子數為3.8NA
Sr原子中含中子數為3.8NA
D. 0.1mol·L-1的NH4NO3溶液中含有的氮原子數為0.2NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com