
硫酸亞鐵銨(NH4)2Fe(SO4)2·6H2O是一種淺綠色晶體,在水中的溶解度較小,不溶于乙醇。某實驗小組利用鍍鋅鐵片來制備硫酸亞鐵銨的過程如下:

(1)加入鹽酸是為了除去鋅鍍層,判斷鋅鍍層已被除去的現象是 。
(2)A物質可以是 (選填序號)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物質的目的是 。
(3)操作Ⅱ的名稱為 。
(4)采用晾干而不用加熱烘干晶體的原因是 。
(5)工業上常用K2Cr2O7溶液測定硫酸亞鐵銨的純度,反應中Cr2O72—被還原成Cr3+。
寫出硫酸亞鐵銨溶液與酸性K2Cr2O7溶液反應的離子方程式 。
16.(12分)
(1)反應速率突然減小(或鐵片表面生成的氣泡突然減少,意思相近均給分)(2分)
(2)b、d(2分,答對1個給1分,答對2個給2分,見錯不給分)
加快鐵與稀硫酸的反應速率(2分)
(3)過濾(2分)
(4)避免加熱過程中晶體受熱分解失去結晶水或被空氣氧化(2分)
(5)6Fe2++Cr2O72—+14H+=2Cr3++6Fe3++7H2O(2分)
【解析】
試題分析:
(1)鍍鋅鐵片放入鹽酸中可以形成Zn-HCl-Fe原電池,并且能加快H+的反應速率,具體現象是氣泡突然減少。
(2)加入的A物質主要是為后續反應加快速率,通過構成Fe-H2SO4-Cu原電池來實現,最終溶液中要生成FeSO4,所以a.CuCl2 不能選,最終會有FeCl2雜質,c.Cu(NO3)2 會帶來NO3-離子,將會產生有毒氣氮氧化物且會帶來雜質Cu(NO3)2,只有b.CuO 和d.CuSO4不會帶來雜質且能加快反應速率。
(3)操作Ⅱ的名稱為過濾,除去未反應完的鐵和銅。
(4)由于目標物中(NH4)2Fe(SO4)2·6H2O中的即有結晶水,同時鐵為+2 價,若采用加熱烘干可能會失去結晶水和加快+2 價的氧化。
(5)根據氧化還原規律,一個反應中有元素化合升高,必然有降低的,題目已經告訴了Cr2O72—被還原成Cr3+元素化合價是降低的,硫酸亞鐵銨溶液中只有Fe2+化合價升高到+3價,先根據得失電子相等寫出6Fe2++Cr2O72—=2Cr3++6Fe3+,再根據溶液的性質通過電荷守恒完成方程式缺項配平,左邊加H+,在邊加H2O;
考點:本題以工藝流程為基礎,考元素及化合物、化學實驗基本操作、原電池原理和氧化還原方程式配平等相關知識。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2012屆浙江省杭州市學軍中學高三上學期第一次月考化學試卷 題型:實驗題
( 8分)亞鐵鹽在空氣中易被氧化,但形成復鹽可穩定存在。硫酸亞鐵銨[(NH4)2SO4?FeSO4?6H2O]是一種重要化學試劑,實驗室可用純鐵片來制
8分)亞鐵鹽在空氣中易被氧化,但形成復鹽可穩定存在。硫酸亞鐵銨[(NH4)2SO4?FeSO4?6H2O]是一種重要化學試劑,實驗室可用純鐵片來制 取硫酸亞鐵銨,流程如下:
取硫酸亞鐵銨,流程如下:
請回答下列問題:
(1)操作Ⅰ的名稱是 ,所用主要儀器和用品有(鐵架臺、鐵圈除外)
,所用主要儀器和用品有(鐵架臺、鐵圈除外)
。
(2)若A物質為CuSO4,其加入的目的是 ,則固體B的成分為 。
(3)加少量硫酸可以調節pH為 1~2,其作用是 。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年江西省九江市七校高三第二次聯考化學試卷(解析版) 題型:填空題
亞鐵鹽在空氣中易被氧化,但形成復鹽可穩定存在。硫酸亞鐵銨[(NH4)2SO4?FeSO4?6H2O]是一種重要化學試劑,實驗室可用純鐵片來制取硫酸亞鐵銨,流程如下:
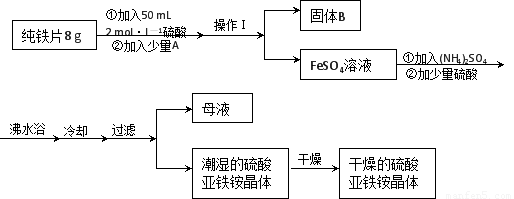
請回答下列問題:
(1)操作Ⅰ的名稱是 ???????? ,所用主要儀器和用品有(鐵架臺、鐵圈除外)??????????? 。
(2)若A物質為CuSO4,其加入的目的是???????????????? ,則固體B的成分為????????? 。
(3)加少量硫酸可以調節pH為 1~2,其作用是??????????????????????????????????????? 。
查看答案和解析>>
科目:高中化學 來源:2012年魯科版高中化學選修6 3.1 物質組分的檢驗練習卷(解析版) 題型:實驗題
硫酸亞鐵銨[(NH4)2SO4·FeSO4·6H2O]為淺綠色晶體,實驗室中常以廢鐵屑為原料來制備,其步驟如下:
步驟1 將廢鐵屑放入碳酸鈉溶液中煮沸除油污,分離出液體,用水洗凈鐵屑。
步驟2 向處理過的鐵屑中加入過量的3 mol·L-1H2SO4溶液,在60 ℃左右使其反應到不再產生氣體,趁熱過濾,得FeSO4溶液。
步驟3 向所得FeSO4溶液中加入飽和(NH4)2SO4溶液,經過“一系列操作”后得到硫酸亞鐵銨晶體。
請回答下列問題:
(1)在步驟1的操作中,下列儀器中不必用到的有________(填儀器編號);
①鐵架臺 ②燃燒匙 ③錐形瓶 ④廣口瓶 ⑤研缽 ⑥玻璃棒 ⑦酒精燈
(2)在步驟2中所加的硫酸必須過量,其原因是
________________________________________________________________________;
(3)在步驟3中,“一系列操作”依次為________、________和過濾;
(4)本實驗制得的硫酸亞鐵銨晶體常含有Fe3+雜質。檢驗Fe3+常用的試劑是________________________________________________________________________,可以觀察到的現象是
________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三元月雙周練習化學試卷 題型:實驗題
(12分)硫酸亞鐵銨(NH4)2SO4•FeSO4•6H2O是一種重要化學試劑,實驗室用除去鋅鍍層的鐵片來制取硫酸亞鐵銨,流程如下:
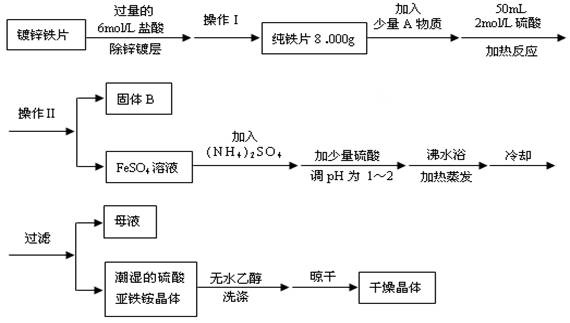
請回答下列問題:
(1)確定鋅鍍層被除去的標志是 ;
計算上述鐵片鋅鍍層的厚度,不需要的數據是 (填編號)。
a.鋅的密度ρ(g/cm3) b.鍍鋅鐵片質量m 1(g) c.純鐵片質量m 2(g)
d.鍍鋅鐵片面積S(cm2) e.鍍鋅鐵片厚度h(cm)
(2)上述流程中:操作Ⅰ是取出鐵片、 、 、稱量。
(3)A物質可以為 (填編號)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(4)用無水乙醇洗滌潮濕的硫酸亞鐵銨晶體是為了除去晶體表面殘留的水分,不用加熱烘干的原因是 。
(5)鑒定所得晶體中含有Fe2+、NH4+、SO42-離子的實驗方法正確的是 (填編號)。
a.取少量樣品于試管,加水溶解,通入適量Cl2,再加KSCN溶液,觀察現象
b.取少量樣品于試管,加水溶解,加入NaOH溶液,露置于空氣中,觀察現象
c.取少量樣品于試管,加水溶解,加入濃NaOH溶液并加熱,用濕潤的紅色石蕊試紙置于試管口,觀察試紙顏色的變化
d.取少量樣品于試管,加水溶解,加入鹽酸后再加入BaCl2溶液,觀察現象
查看答案和解析>>
科目:高中化學 來源:2010-2011學年江西省高三下學期第一次模擬考試(理綜)化學部分 題型:化學題
根據廢水中所含有害物質的不同,工業上有多種廢水的處理方法。

(1)①廢水I若采用CO2處理,離子方程式是 。
②廢水Ⅱ常用明礬處理。實踐中發現廢水中的c(HCO-3)越大,凈水效果越好,這是因為
。
③廢水III中的汞元素存在如下轉化(在空格上填相應的化學式):
Hg2++ =====CH3Hg++H+我國規定,Hg2+的排放標準不能超過0.05 mg/L。若某工廠排放的廢水1 L中含Hg2+3×10-17mo1,是否達到了排放標準 (填“是”或“否”)。
④廢水Ⅳ常用C12氧化CN-成CO2和N2,若參加反應的C12與CN-的物質的量之比為5:2,則該反應的離子方程式為 。
(2)化學需氧量(COD)可量度水體受有機物污染的程度,它是指在一定條件下,用強氧化劑處理水樣時所消耗的氧化剎的量,換算成氧的含量(以mg/L計)。某研究性學習小組測定某水樣的化學需氧量(COD),過程如下:
I.取V1mL水樣于錐形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少許,然后慢慢加入硫酸酸化,混合均勻,加熱。
III.反應完畢后,冷卻,加指示劑,用c mol/L的硫酸亞鐵銨[(NH4)2Fe(SO4)2]溶液滴定。終點時消耗硫酸亞鐵銨溶液V2 mL。
①I中,量取K2Cr2O7,溶液的儀器是 。
②III中,發生的反應為:Cr2O72-+6Fe2++14 H+==2Cr3++6Fe3++7H2O
由此可知,該水樣的化學需氧量COD= (用含c、V1、V2的表達式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com