
(15分)研究NO2、SO2 、CO等大氣污染氣體的測量及處理具有重要意義。
⑴I2O5可使H2S、CO、HC1等氧化,常用于定量測定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
寫出CO(g)與I2O5(s)反應(yīng)生成I2(s)和CO2(g)的熱化學(xué)方程式: 。
⑵一定條件下,NO2與SO2反應(yīng)生成SO3和NO兩種氣體。將體積比為1∶2的NO2、SO2氣體置于密閉容器中發(fā)生上述反應(yīng),下列能說明反應(yīng)達到平衡狀態(tài)的是 ,
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變 d.每消耗1 mol SO2的同時生成1 molNO
測得上述反應(yīng)平衡時NO2與SO2體積比為1∶6,則平衡常數(shù)K= 。
⑶從脫硝、脫硫后的煙氣中獲取二氧化碳,用二氧化碳合成甲醇是碳減排的新方向。將CO2轉(zhuǎn)化為甲醇的熱化學(xué)方程式為:CO2(g)+3H2(g)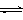 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等體體積CO2和H2的的混合氣體 (物質(zhì)的量之比均為1:3),分別加入溫度不同、容積相同的恒容密閉容器中,發(fā)生上述反應(yīng),反應(yīng)相同時間后,測得甲醇的體積分數(shù)φ(CH3OH) 與反應(yīng)溫度T的關(guān)系曲線如圖所示,則上述CO2轉(zhuǎn)化為甲醇反應(yīng)的△H3 0(填“>”、“<”或“=”)。
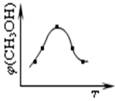
②在容積為1L的恒溫密閉容器中充入1 mol CO2和3 mol H2,進行上述反應(yīng)。測得CO2和CH3OH(g)的濃度隨時間變化如下左圖所示。若在上述平衡體系中再充0.5 mol CO2和1.5 mol H2O(g) (保持溫度不變),則此平衡將 移動(填“向正反應(yīng)方向”、“不”或“逆反應(yīng)方向”)
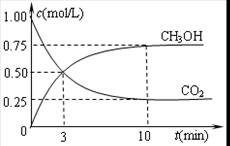
③直接甲醇燃料電池結(jié)構(gòu)如上右圖所示。其工作時負極電極反應(yīng)式可表示為 。
⑴5CO(g) + I2O5(s)=5CO2(g) + I2(s) △H=-1377.22kJ·mol-1(3分)
⑵b (2分) 2.67或8/3(3分)
⑶ ①<(2分) ②不(2分) ③CH3OH-6e-+H2O=6H++CO2(3分)
【解析】(1)考查蓋斯定律的應(yīng)用。根據(jù)反應(yīng)①2I2(s) + 5O2(g)= 2I2O5(s)和反應(yīng)②2CO(g) + O2(g)= 2CO2(g)可知,②×2.5-①÷2即得到5CO(g) + I2O5(s)=5CO2(g) + I2(s),所以該反應(yīng)的反應(yīng)熱是-566.0 kJ·mol-1×2.5+75.56 kJ·mol-1÷2=-1377.22kJ·mol-1。
(2)反應(yīng)NO2(g)+SO2(g) SO3(g)+NO(g)是體積不變的、吸熱的可逆反應(yīng),因此a不能說明。顏色的深淺與氣體的濃度大小有關(guān),而在反應(yīng)體系中只有二氧化氮是紅棕色氣體,所以混合氣體顏色保持不變時即說明NO2的濃度不再發(fā)生變化,因此b可以說明;SO3和NO是生成物,因此在任何情況下二者的體積比總是滿足1:1,c不能說明;SO3和NO2一個作為生成物,一個作為反應(yīng)物,因此在任何情況下每消耗1 mol SO3的同時必然會生成1 molNO2,因此d也不能說明;設(shè)NO2的物質(zhì)的量為1mol,則SO2的物質(zhì)的量為2mol,參加反應(yīng)的NO2的物質(zhì)的量為xmol。 則
SO3(g)+NO(g)是體積不變的、吸熱的可逆反應(yīng),因此a不能說明。顏色的深淺與氣體的濃度大小有關(guān),而在反應(yīng)體系中只有二氧化氮是紅棕色氣體,所以混合氣體顏色保持不變時即說明NO2的濃度不再發(fā)生變化,因此b可以說明;SO3和NO是生成物,因此在任何情況下二者的體積比總是滿足1:1,c不能說明;SO3和NO2一個作為生成物,一個作為反應(yīng)物,因此在任何情況下每消耗1 mol SO3的同時必然會生成1 molNO2,因此d也不能說明;設(shè)NO2的物質(zhì)的量為1mol,則SO2的物質(zhì)的量為2mol,參加反應(yīng)的NO2的物質(zhì)的量為xmol。 則
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol) 1 2 0 0
轉(zhuǎn)化量(mol) x x x x
平衡量(mol) 1-x 2-x x x
所以有 ,解得x=0.8
,解得x=0.8
所以平衡常數(shù)為
(3)①根據(jù)圖像可知,當(dāng)甲醇的含量達到最大值時,如果繼續(xù)升高溫度,甲醇的含量反而降低,這說明升高溫度平衡向逆反應(yīng)方向移動,即正反應(yīng)是放熱反應(yīng)。
②根據(jù)圖像可知平衡時CO2、氫氣、甲醇和水蒸氣的物質(zhì)的量分別是0.25mol、0.75mol、0.75mol和0.75mol,所以平衡常數(shù)為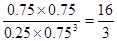 。若在上述平衡體系中再充0.5 mol CO2和1.5 mol H2O(g),則此時
。若在上述平衡體系中再充0.5 mol CO2和1.5 mol H2O(g),則此時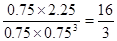 ,所以平衡不移動。
,所以平衡不移動。
(3)甲醇失電子,所以在負極通入。根據(jù)電解質(zhì)可知,負極電極反應(yīng)式為CH3OH-6e-+H2O=6H++CO2。


 名牌中學(xué)課時作業(yè)系列答案
名牌中學(xué)課時作業(yè)系列答案 明天教育課時特訓(xùn)系列答案
明天教育課時特訓(xùn)系列答案 浙江新課程三維目標測評課時特訓(xùn)系列答案
浙江新課程三維目標測評課時特訓(xùn)系列答案 周周清檢測系列答案
周周清檢測系列答案科目:高中化學(xué) 來源: 題型:
 (2011?山東)研究NO2、SO2、CO等大氣污染氣體的處理有重要意義.
(2011?山東)研究NO2、SO2、CO等大氣污染氣體的處理有重要意義.| 催化劑 | △ |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:閱讀理解
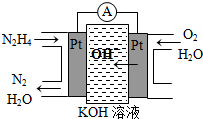 Ⅰ.肼(N2H4)又稱聯(lián)氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用氧化劑.試回答下列問題
Ⅰ.肼(N2H4)又稱聯(lián)氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用氧化劑.試回答下列問題| 物質(zhì) | CO | H2 | CH3OH |
| 濃度(mol?L-1) | 0.9 | 1.0 | 0.6 |
| 2 |
| 3 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
| 催化劑 |
| 加熱 |
| 8 |
| 3 |
| 8 |
| 3 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
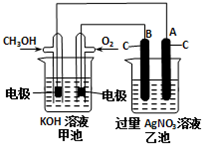 研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.
研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.| 催化劑 | 加熱 |
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com