
【題目】某同學設計的微型實驗裝置驗證SO2的性質,通過分析實驗,下列結論表達正確的是

A. a棉球褪色,驗證SO2具有氧化性
B. b棉球褪色,驗證SO2具有酸性氧化物的通性
C. c棉球藍色褪去,驗證SO2漂白性
D. 可以使用濃硫酸吸收尾氣
【答案】B
【解析】
亞硫酸鈉與濃硫酸反應生成二氧化硫,二氧化硫能使品紅溶液褪色,二氧化硫是酸性氧化物,與堿反應生成亞硫酸鈉和水,碘單質具有氧化性,能夠氧化二氧化硫生成硫酸,據此分析解答。
A.a棉球中品紅褪色,可以驗證SO2具有漂白性,故A錯誤;
B.b棉球褪色,SO2與堿液反應,堿性減弱,溶液褪色,驗證SO2具有酸性氧化物的性質,故B正確;
C.碘與SO2和水反應生成氫碘酸和硫酸,碘單質反應完全,c棉球藍色褪去,可以驗證SO2的還原性,故C錯誤;
D.SO2盡管有還原性,但不能被濃硫酸氧化,因此不能用濃硫酸吸收尾氣,SO2具有酸性氧化物的性質,可以用堿液吸收尾氣,故D錯誤;
答案選B。


科目:高中化學 來源: 題型:
【題目】25℃時,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HA溶液,溶液的pH與所加NaOH溶液體積(V)的關系如圖所示。下列說法不正確的是
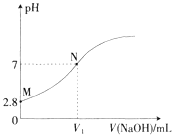
A. V1<20
B. Ka(HA)的數量級為10-5
C. M點溶液加少量水稀釋,![]() 增大
增大
D. N點后,隨著NaOH溶液的加入,溶液中水的電離程度逐漸增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應既屬于氧化還原反應,又是吸熱反應的是:
A.鋁片與稀鹽酸反應B.Ba(OH)2·8H2O與NH4Cl反應
C.灼熱的碳與CO反應D.甲烷在氧氣中燃燒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)利用原電池裝置可以驗證Fe3+與Cu2+氧化性相對強弱,如下圖所示。

該方案的實驗原理是自發進行的氧化還原反應可以設計為原電池。寫出該氧化還原反應的離子方程式:__________。該裝置中的負極材料是______(填化學式),正極反應式是_______。
(2)某研究性學習小組為證明2Fe3++2I-2Fe2++I2為可逆反應,設計如下兩種方案。
方案一:
取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,再繼續加入2mLCCl4,充分振蕩、靜置、分層,再取上層清液,滴加KSCN溶液。
①方案一中能證明該反應為可逆反應的現象是______。
②有同學認為方案一設計不夠嚴密,即使該反應為不可逆反應也可能出現上述現象,其原因是(用離子方程式表示)_____。
方案二:
設計如下圖原電池裝置,接通靈敏電流計,指針向右偏轉(注:靈敏電流計指針總是偏向電源正極),隨著時間進行電流計讀數逐漸變小,最后讀數變為零。當指針讀數變零后,在右管中加入1mol/L FeCl2溶液。

③方案二中,“讀數變為零”是因為____________.
④“在右管中加入1mol/L FeCl2溶液”后,觀察到靈敏電流計的指針______偏轉(填“向左”、“向右”或“不”),可證明該反應為可逆反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酰乙酸乙酯是有機合成中非常重要的原料,實驗室制備乙酰乙酸乙酯的反應原理、裝置示意圖和有關數據如下所示:


實驗步驟:
(I)合成:向三頸燒瓶中加入9.8 mL無水乙酸乙酯,迅速加入0.1 g切細的金屬鈉。水浴加熱反應液,緩慢回流約2h至金屬鈉全部反應完。停止加熱,冷卻后向反應混合物中加入50%乙酸至反應液呈弱酸性。
(II)分離與提純:
①向反應混合物中加入等體積的飽和食鹽水,分離得到有機層。
②水層用5 mL無水乙酸乙酯萃取,分液。
③將①②所得有機層合并,洗滌、干燥、蒸餾得到乙酰乙酸乙酯粗產品。
④蒸餾粗產品得到乙酰乙酸乙酯3.9g。
(l)迅速加入金屬鈉的原因是_________(用化學方程式說明)。
(2)球形冷凝管中冷卻水從_____(填“上”或“下”)口進入,上方干燥管中盛有無水CaCl2,其作用是_______。
(3)實驗室制備乙酰乙酸乙酯時,通常在無水乙酸乙酯中加入微量的無水乙醇,其作用是_______。
(4)分離與提純操作①中使用的分離儀器是_______。加入飽和食鹽水的作用是_______。
(5)分離與提純操作③用飽和NaHCO3溶液洗滌的目的是______________。
(6)本實驗的產率為______%(結果保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質中,都是強電解質的是( )
A.HNO3、HCl、BaSO4B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2OD.HClO、CH3COONa、Ba(OH)2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式中正確的是
A. FeBr2溶液中加入等物質的量的Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++Br2+4Cl-
B. 用氫氟酸在玻璃上“刻字”:SiO2 + 4H+ + 4F- = SiF4↑+ 2H2O
C. 將銅絲投入稀硝酸中:Cu + 4H+ + 2NO3-= Cu2+ + 2NO2↑+ 2H2O
D. NaOH與NH4Cl溶液混合加熱:NH4+ + OH- ![]() NH3·H2O
NH3·H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E都為短周期元素,A是相對原子質量最小的元素;B的+1價陽離子和C的-1價陰離子都與氖原子具有相同的電子層結構;D在C的下一周期,可與B形成BD型離子化合物;E和C為同一周期元素,其最高價氧化物對應的水化物為一種強酸.請根據以上信息回答下列問題.
(1)C元素在元素周期表中的位置是________________
(2)畫出B元素的離子結構示意圖______________
(3)與E的氫化物分子所含電子總數相等的分子是_____(舉一例,填化學式,下同)、離子是_________
(4)D的單質與B的最高價氧化物對應的水化物的溶液發生反應的離子方程式為_________
(5)寫出A元素與B元素形成化合物的化學式________
(6)下列可以判斷C和D非金屬性強弱的是_______
a.單質的熔點C比D低 b.單質與氫氣反應C比D劇烈
c.氣態氫化物穩定性C比D穩定 d.單質的密度C比D小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2mol金屬鈉和1mol氯氣反應的能量關系如圖所示,下列說法不正確的是

A. 相同條件下,K(s)的(ΔH2′+ΔH3′)<Na(s)的(ΔH2+ΔH3)
B. ΔH4的值數值上和Cl-Cl共價鍵的鍵能相等
C. ΔH5<0,在相同條件下,2Br(g)的ΔH5′>ΔH5
D. ΔH7<0,且該過程形成了分子間作用力
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com