
【題目】下列描述中不正確的是( )
A. CS2為Ⅴ形的極性分子 B. ClO3-的空間構型為三角錐形
C. SF6中有6對完全相同的成鍵電子對 D. SiF4和SO32-的中心原子均為sp3雜化
科目:高中化學 來源: 題型:
【題目】在5 L的密閉容器中,一定條件下發生化學反應:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。起始反應時NO和CO各為3 mol,保持密閉容器體積不變,10秒鐘達到化學平衡,測得N2為1 mol。下列有關反應速率的說法中,正確的是
N2(g)+2CO2(g)。起始反應時NO和CO各為3 mol,保持密閉容器體積不變,10秒鐘達到化學平衡,測得N2為1 mol。下列有關反應速率的說法中,正確的是
A.達到平衡后,若將容器體積壓縮為2 L,則正反應速率將增大,逆反應速率將減小
B.反應前5秒鐘內,用CO表示的平均反應速率為0.04 mol·L-1·s-1
C.當v正(CO)=2v逆(N2)時,該反應中NO的物質的量不再改變
D.保持壓強不變,往容器中充入1 mol He,正、逆反應速率都不改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把3molA和2.5molB混合與2L密閉容器中,發生反應:3A(g)+B(g)![]() xC(g)+2D(g),5min后達平衡,容器內壓強變小,測得D的平均反應速率為0.1mol/(L·min)。求:
xC(g)+2D(g),5min后達平衡,容器內壓強變小,測得D的平均反應速率為0.1mol/(L·min)。求:
(1)x= 。
(2)平衡時C的濃度為多少?(要求寫出計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】異苯丙醛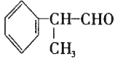 在工業上有重要用途,其合成流程如下:
在工業上有重要用途,其合成流程如下:

(1)異苯丙醛被酸性高錳酸鉀氧化后所得有機物的結構簡式是____________。
(2)在合成流程上②的反應類型是____________,反應④發生的條件是____________,
(3)反應⑤的化學方程式為____________。
(4)異苯丙醛發生銀鏡反應的化學方程式為__________。
(5)D物質與有機物X在一定條件下可生成一種相對分子質量為178的酯類物質,則X的名稱是____________。D物質有多種同分異構體,其中滿足苯環上有兩個取代基,且能使FeCl3溶液顯紫色的同分異構體有____________種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D四種元素,原子序數依次增大,A原子的最外層上有4個電子;B的陰離子和C的陽離子具有相同的電子層結構,兩元素的單質反應,生成一種淡黃色的固體E,D的L層電子數等于K、M兩個電子層上的電子數之和。
(1)C離子的結構示意圖為 。D在周期表中位置 。
(2)寫出E的電子式: 。
(3)A、D兩元素形成的化合物屬 (填“離子”或“共價”)化合物。
(4)寫出D的最高價氧化物的水化物和A反應的化學方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在汽車上安裝三效催化轉化器,可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應,生成無毒物質,減少汽車尾氣污染。某研究性學習小組探究某種催化劑在不同空燃比(空氣與燃油氣的質量比)條件下對汽車尾氣的催化效果。在一定條件下,測得尾氣中的主要污染物的轉化率與空燃比的關系如右圖所示。空燃比約為 時,催化劑對汽車尾氣的催化效果最好。(填a、b、c、d)

(2)工業上也常用NaOH溶液吸收法處理NOx ,已知:NO + NO2 + 2NaOH= 2NaNO2 + H2O(I)
2NO2 + 2NaOH =NaNO2 + NaNO3 + H2O(II)
現有2 240 mL(標準狀況)NO 和NO2的混合氣體溶于200 mL NaOH溶液中,恰好完全反應,并無氣體放出,則NaOH溶液物質的量濃度是 。
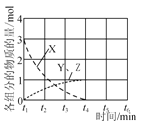
(3)NO直接催化分解(生成N2與O2)也是一種脫硝途徑。在不同條件下,NO的分解產物不同。在高壓下,NO在40 ℃下分解生成兩種化合物,體系中各組分物質的量隨時間變化曲線如圖所示。寫出Y和Z的化學式:__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸鈷可用于指示劑和催化劑的制備。用水鈷礦(主要成分為Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工藝流程如下:
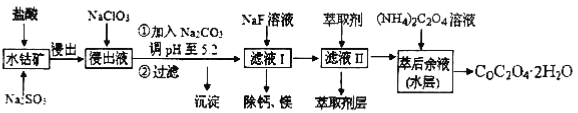
已知:①浸出液含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:

(1)浸出過程中加入Na2SO3的目的是_______________。
(2)NaClO3在反應中氯元素被還原為最低價,該反應的離子方程式為
____________________________________________________________________________
(3)加Na2CO3能使浸出液中某些金屬離子轉化成氫氧化物沉淀。試用離子方程式和必要的文字簡述其原理:_______________________________________________________
(4)濾液I“除鈣、鎂”是將其轉化為MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,當加入過量NaF后,所得濾液=______。
(5)萃取劑對金屬離子的萃取率與pH的關系如右圖所示,在濾液II中適宜萃取的pH為___左右。
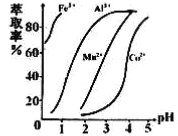
a.1 b.2 c.3 d.4
(6)已知:NH3·H2O![]() NH4++OH- Kb=1.8×10-5;
NH4++OH- Kb=1.8×10-5;
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2;HC2O4-
H++HC2O4- Ka1=5.4×10-2;HC2O4-![]() H++C2O42- Ka2=5.4×10-5;
H++C2O42- Ka2=5.4×10-5;
則該流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
(7)CoC2O4·2H2O熱分解質量變化過程如右圖所示(其中600℃以前是隔絕空氣加熱,,600℃以后是在空氣中加熱);A、B、C均為純凈物;C點所示產物的化學式是__________
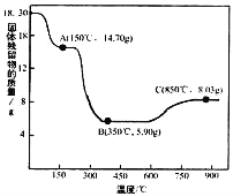
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素①~⑧在元素周期表中的位置如下,回答有關問題:
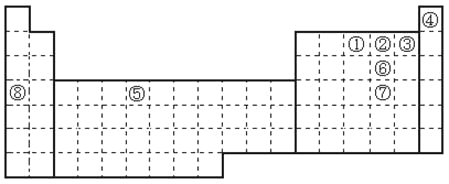
(1)寫出①~⑧號元素中第一電離能最大的元素符號___________。
(2)寫出②⑥⑦三個元素氣態氫化學的沸點順序___________。(填分子式順序)
(3)請畫出[Cu(NH3)4]2+離子結構示意圖___________。
(4)請畫出⑤的外圍電子排布圖___________。
(5)SeO3的空間構型為___________。
(6)SeO32-離子的VSEPR構型為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】計算多元弱酸(HnX)溶液的c(H+)及比較弱酸的相對強弱時,通常只考慮第一步電離。回答下列關于多元弱酸HnX的問題。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是__________。
A.升高溫度 B.加少量固態HnX C.加少量NaOH溶液 D.加水
(2)用離子方程式解釋NanX呈堿性的原因:______________________________。
(3)若HnX為H2C2O4,且某溫度下,H2C2O4的K1=5×10-2、K2=5×10-5.則該溫度下,0.2mol/L H2C2O4溶液中c(H+)約為__________mol/L。(精確計算,且己知![]() )
)
(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各離子濃度由大到小的順序是____________________。
②在KHC2O4溶液中,各粒子濃度關系正確的是__________。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O42-)+2c(C2O42-)
D.c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com