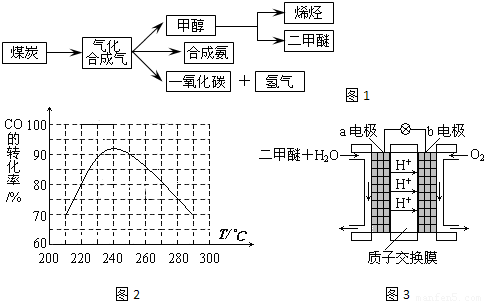
圖1是煤化工產(chǎn)業(yè)鏈的一部分,試運(yùn)用所學(xué)知識(shí),解決下列問題:
I.已知該產(chǎn)業(yè)鏈中某反應(yīng)的平衡表達(dá)式為:K=
,它所對(duì)應(yīng)反應(yīng)的化學(xué)方程式為
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
.
II.二甲醚(CH
3OCH
3)在未來可能替代柴油和液化氣作為潔凈液體燃料使用,工業(yè)上以CO和H
2為原料生產(chǎn)CH
3OCH
3.工業(yè)制備二甲醚在催化反應(yīng)室中(壓力2.0~10.0Mpa,溫度230~280℃)進(jìn)行下列反應(yīng):
①CO(g)+2H
2(g)
CH
3OH(g)△H
1=-90.7kJ?mol
-1②2CH
3OH(g)
CH
3OCH
3(g)+H
2O(g)△H
2=-23.5kJ?mol
-1③CO(g)+H
2O(g)
CO
2(g)+H
2(g)△H
3=-41.2kJ?mol
-1(1)催化反應(yīng)室中總反應(yīng)的熱化學(xué)方程式為
3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247KJ?mol-1
3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247KJ?mol-1
.830℃時(shí)反應(yīng)③的K=1.0,則在催化反應(yīng)室中反應(yīng)③的K
>
>
1.0(填“>”、“<”或“=”).
(2)在某溫度下,若反應(yīng)①的起始濃度分別為:c(CO)=1mol/L,c(H
2)=2.4mol/L,5min后達(dá)到平衡,CO的轉(zhuǎn)化率為50%,則5min內(nèi)CO的平均反應(yīng)速率為
0.1mol/(L?min)
0.1mol/(L?min)
;若反應(yīng)物的起始濃度分別為:c(CO)=4mol/L,c(H
2)=a mol/L;達(dá)到平衡后,c(CH
3OH)=2mol/L,a=
5.4
5.4
mol/L.
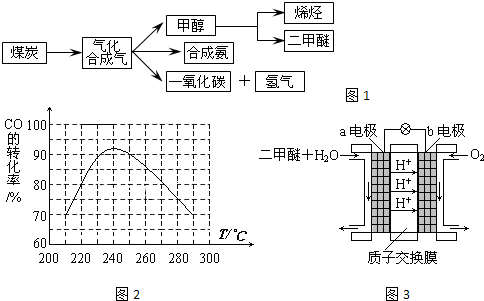
(3)為了尋找合適的反應(yīng)溫度,研究者進(jìn)行了一系列試驗(yàn),每次試驗(yàn)保持原料氣組成、壓強(qiáng)、反應(yīng)時(shí)間等因素不變,試驗(yàn)結(jié)果如圖2,CO轉(zhuǎn)化率隨溫度變化的規(guī)律是
由圖表可知,溫度低于240℃時(shí),CO的轉(zhuǎn)化率隨著溫度的升高而增大;溫度高于240℃時(shí),CO的轉(zhuǎn)化率隨著溫度的升高而減小
由圖表可知,溫度低于240℃時(shí),CO的轉(zhuǎn)化率隨著溫度的升高而增大;溫度高于240℃時(shí),CO的轉(zhuǎn)化率隨著溫度的升高而減小
,其原因是
在較低溫時(shí),各反應(yīng)體系均未達(dá)到平衡,CO的轉(zhuǎn)化率主要受反應(yīng)速率影響,隨著溫度的升高反應(yīng)速率增大,CO的轉(zhuǎn)化率也增大;在較高溫時(shí),各反應(yīng)體系均已達(dá)到平衡,CO的轉(zhuǎn)化率主要受反應(yīng)限度影響,隨著溫度的升高平衡向逆反應(yīng)方向移動(dòng),CO的轉(zhuǎn)化率減小
在較低溫時(shí),各反應(yīng)體系均未達(dá)到平衡,CO的轉(zhuǎn)化率主要受反應(yīng)速率影響,隨著溫度的升高反應(yīng)速率增大,CO的轉(zhuǎn)化率也增大;在較高溫時(shí),各反應(yīng)體系均已達(dá)到平衡,CO的轉(zhuǎn)化率主要受反應(yīng)限度影響,隨著溫度的升高平衡向逆反應(yīng)方向移動(dòng),CO的轉(zhuǎn)化率減小
.
(4)“二甲醚燃料電池”是一種綠色電源,其工作原理如圖3所示.寫出a電極上發(fā)生的電極反應(yīng)式
CH3OCH3+3H2O-12e-=2CO2+12H+
CH3OCH3+3H2O-12e-=2CO2+12H+
.






 .已知N-N鍵鍵能為167kJ?mol-1,NO2中氮氧鍵的鍵能為466kJ?mol-1,N2O4中氮氧鍵的鍵能為438.5kJ?mol-1.請(qǐng)寫出NO2轉(zhuǎn)化為N2O4的熱化學(xué)方程式為
.已知N-N鍵鍵能為167kJ?mol-1,NO2中氮氧鍵的鍵能為466kJ?mol-1,N2O4中氮氧鍵的鍵能為438.5kJ?mol-1.請(qǐng)寫出NO2轉(zhuǎn)化為N2O4的熱化學(xué)方程式為

 ,它所對(duì)應(yīng)的化學(xué)反應(yīng)為: .
,它所對(duì)應(yīng)的化學(xué)反應(yīng)為: .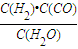 ,它所對(duì)應(yīng)反應(yīng)的化學(xué)方程式為______.
,它所對(duì)應(yīng)反應(yīng)的化學(xué)方程式為______.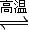 CH3OH(g)△H1=-90.7kJ?mol-1
CH3OH(g)△H1=-90.7kJ?mol-1 CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1 CO2(g)+H2(g)△H3=-41.2kJ?mol-1
CO2(g)+H2(g)△H3=-41.2kJ?mol-1