
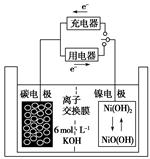
| A.放電時K+移向負極 |
| B.放電時電池負極的電極反應為:H2-2e-=2H+ |
| C.放電時電池正極的電極反應為:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| D.該電池充電時將碳電極與電源的正極相連 |
科目:高中化學 來源:不詳 題型:單選題
A.
| B.
| C.14+
| D.14+
|
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.同濃度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 | ||||||||
| B.BaCO3的懸濁液中加入少量的新制氯水,c(Ba2+)增大 | ||||||||
C.BaSO4和BaCO3共存的懸濁液中
| ||||||||
| D.BaSO4懸濁液中加入Na2CO3濃溶液,BaSO4不可能轉化為BaCO3 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 Fe2++Cr3+。下列說法一定正確的是
Fe2++Cr3+。下列說法一定正確的是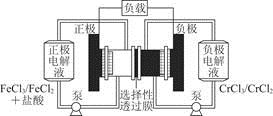
| A.充電時,陰極的電極反應式為Cr3++e-=Cr2+ |
| B.電池放電時,負極的電極反應式為Fe2+-e-=Fe3+ |
| C.電池放電時,Cl-從負極室穿過選擇性透過膜移向正極室 |
| D.放電時,電路中每流過0.1 mol電子,Fe3+濃度降低0.1 mol·L-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.充電時陽極反應為Li++e-=Li |
| B.充電時動力電池上標注“-”的電極應與外接電源的負極相連 |
| C.放電時電池內部Li+向負極移動 |
| D.放電時,在正極上是Li+得電子被還原 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.氫氧燃料電池的負極反應式:O2 + 2H2O+ 4e- = 4OH - |
| B.鉛蓄電池充電時,標示“+”的接線柱連電源的正極,電極反應式為:PbSO4(S)-2e - + 2H2O(l)=PbO2(S) + 4H+(aq)+ SO42-(aq) |
| C.粗銅精煉時,與電源正極相連的是純銅,電極反應式為:Cu-2e- = Cu2+ |
| D.鋼鐵發生電化學腐蝕的正極反應式:Fe-2e - = Fe2+ |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0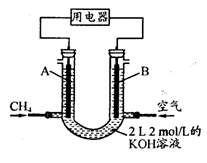
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
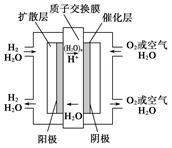
| A.通入氧氣的電極發生氧化反應 |
| B.通入氫氣的電極為正極 |
C.總反應式為O2+2H2 2H2O 2H2O |
| D.正極的電極反應式為O2+4H++4e-===2H2O |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.負極,被氧化 | B.負極,被還原 |
| C.正極,被還原 | D.正極,被氧化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com