分析:(1)①a.硫酸常溫下溫度,不易分解.
b.反應中二氧化硫表現還原性,氧化性比HI強.
c.1molSO
2消耗2molH
2O生成1molH
2SO
4,1molH
2SO
4分解生成1molSO
2與1molH
2O.
d.由Ⅲ可知產生lmolO
2的同時產生2molSO
2,由I可知2molSO
2生成4molHI,由Ⅱ可知4molHI分解生成2mol H
2.
②計算該濃度下的溶度積Qc,與平衡常數k=1比較,若Qc=1,處于平衡狀態,若Qc>1,平衡向逆反應移動,若Qc<1,向正反應移動.
③實驗室用Zn和稀硫酸制取H
2,隨反應進行溶液中氫離子濃度降低,水的電離平衡增大;增大氫離子的濃度、加熱、形成原電池等可以加快反應速率.
(2)化學反應達到平衡狀態時,正逆反應速率相等,各物質的濃度不變,由此衍生的一些物理量也不變.
a.恒溫、恒容條件下,隨反應進行反應混合物的物質的量減小,體系壓強減小,容器內的壓強不發生變化,說明到達平衡.
b.CH
3OH分解的速率和CH
3OH生成的速率相等,正逆反應速率相等,反應達平衡狀態.
c.各物質的濃度不變,說明到達平衡狀態.
d.單位時間內消耗1mol CO,同時生成l mol CH
3OH,都表示正反應速率,自始至終都按1:1進行.
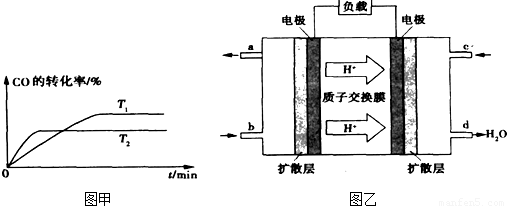
②溫度越高反應速率越快,到達平衡時間越短,故T
1<T
2,溫度越高CO的轉化率越小,升高溫度平衡向逆反應移動.
③由質子的定向移動可知左側電極為燃料電池的負極,右側電極為燃料電池的正極,負極發生氧化反應,甲醇在負極放電,正極反應還原反應,氧氣在正極放電,負極電極反應式為
CH
3OH(l)+H
2O(l)-6e
-=CO
2(g)+6H
+,正極反應式為O
2+4e
-+4H
+=2H
2O.6.4g甲醇(CH
3OH)的物質的量為
=0.2mol,根據電極反應式計算轉移電子的物質的量.
解答:解:(1)①a.硫酸常溫下溫度,不易分解,故a錯誤;
b.反應中二氧化硫表現還原性,氧化性比HI強,故b錯誤;
c.1molSO
2消耗2molH
2O生成1molH
2SO
4,1molH
2SO
4分解生成1molSO
2與1molH
2O,循環中水的量減少,故應補充水,故c正確;
d.由Ⅲ可知產生lmolO
2的同時產生2molSO
2,由I可知2molSO
2生成4molHI,由Ⅱ可知4molHI分解生成2mol H
2,即循環過程中產生l mol O
2的同時產生2mol H
2,故d錯誤;
故選:c;
②濃度商Qc=
=0.6<1,所以平衡向正反應移動,即v
正>v
逆,故選:>;
③實驗室用Zn和稀硫酸制取H
2,隨反應進行溶液中氫離子濃度降低,水的電離平衡增大,向右移動;
a.加入NaNO
3,氫離子濃度不變,不能增大氫氣的生成速率,故a錯誤;
b.加入CuSO
4,形成原電池,加快氫氣的生成速率,故b正確;
c.加入Na
2SO
4,氫離子濃度不變,不能增大氫氣的生成速率,故c錯誤;
d.加入NaHSO
3,與氫離子反應,氫離子濃度降低,氫氣的生成速率降低,故d錯誤;
故答案為:向右;b;
(2)化學反應達到平衡狀態時,正逆反應速率相等,各物質的濃度不變,由此衍生的一些物理量也不變.
a.恒溫、恒容條件下,隨反應進行反應混合物的物質的量減小,體系壓強減小,容器內的壓強不發生變化,說明到達平衡,故a正確;
b.CH
3OH分解的速率和CH
3OH生成的速率相等,正逆反應速率相等,反應達平衡狀態,故b正確;
c.CO、H
2和CH
3OH的濃度保持不變,說明到達平衡狀態,故c正確;
d.單位時間內消耗1mol CO,同時生成l mol CH
3OH,都表示正反應速率,自始至終都按1:1進行,故d錯誤;
故選:d;
②溫度越高反應速率越快,到達平衡時間越短,故T
1<T
2,溫度越高CO的轉化率越小,升高溫度平衡向逆反應移動,溫度平衡常數降低,溫度越高平衡常數越小,即K
1>K
2,
故答案為:>;
③由質子的定向移動可知左側電極為燃料電池的負極,右側電極為燃料電池的正極,負極發生氧化反應,甲醇在負極放電,故b通入CH
3OH;正極反應還原反應,氧氣在正極放電,正極反應式為O
2+4e
-+4H
+=2H
2O;6.4g甲醇(CH
3OH)的物質的量為
=0.2mol,由負極電極反應式為CH
3OH+H
2O-6e
-=CO
2+6H
+可知轉移電子的物質的量為0.2mol×6=1.2mol,
故答案為:CH
3OH;O
2+4e
-+4H
+=2H
2O;1.2.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案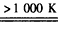 MnFe2O4-x+x/2_______
MnFe2O4-x+x/2_______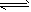 CO(g)+3H2(g);△H= +206.1 kJ/mol
CO(g)+3H2(g);△H= +206.1 kJ/mol 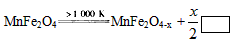 則框內的物質為:________; 第二步反應方程式為:
則框內的物質為:________; 第二步反應方程式為: H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O CH3OH(g)分析該反應并回答下列問題:
CH3OH(g)分析該反應并回答下列問題: