
【題目】干冰、石墨、C60、氟化鈣和金剛石的結構模型如圖所示(石墨僅表示出其中的一層結構):
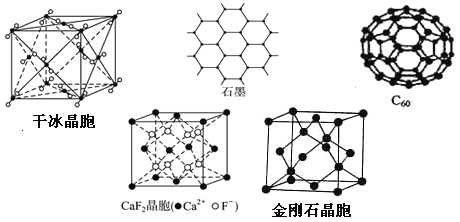
回答下列問題:
(1)干冰晶胞中,每個CO2分子周圍有________個與之緊鄰且等距的CO2分子。
(2)由金剛石晶胞可知,每個金剛石晶胞占有________個碳原子。
(3)石墨層狀結構中,平均每個正六邊形占有的碳原子數是________。
(4)在CaF2晶體中,Ca2+的配位數是________,F-的配位數是________。
(5)固態時,C60屬于________ (填“原子”或“分子”)晶體。
【答案】12 8 2 8 4 分子
【解析】
根據各種晶胞的結構進行分析判斷;
(1)干冰是分子晶體, CO2分子位于立方體的頂點和面心上,以頂點上的CO2分子為例,與它距離最近的CO2分子分布在與該頂點相連的12個面的面心上,所以干冰晶胞中,每個CO2分子周圍有12個與之緊鄰且等距的CO2分子;因此,本題正確答案是:12;
(2)金剛石晶胞中碳原子占據立方體的面心和頂點,晶胞內部有4個碳原子,則每個金剛石晶胞占有碳原子數為:![]() +
+![]() 6+4=8,因此,本題正確答案是:8;
6+4=8,因此,本題正確答案是:8;
(3)石墨層狀結構中,每個碳原子被三個正六邊形共用,所以平均每個正六邊形占有的碳原子數=6×![]() =2;答案:2。
=2;答案:2。
(4)在CaF2晶胞中每個Ca2+連接4個氟離子,但在下面一個晶胞中又連接4個氟離子,即每個Ca位于8個F構成的立方體體心,所以其配位數為8;同理每個F均位于四個Ca2+構成的正四面體的體心,所以其配位數為4,因此,本題正確答案是:8;4;
(5)C60中構成微粒是分子,所以屬于分子晶體;答案:分子。


 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源: 題型:
【題目】有機物A只由C、H、O三種元素組成,常用作有機合成的中間體,測得8.4g該有機物經燃燒生成22.0g CO2和7.2g水,質譜圖表明其相對分子質量為84;紅外光譜分析表明A中含有-OH和位于分子端的-C≡C-,核磁共振氫譜顯示有3種峰,且峰面積之比為6:1:1。試通過計算求A的分子式和結構簡式____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】福酚美克是一種影響機體免疫力功能的藥物,可通過以下方法合成:
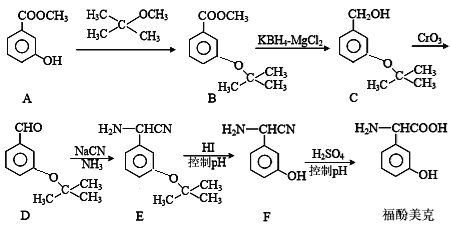
(1)物質A的名稱是__________________________
(2)B→C的轉化屬于_______反應(填反應類型)。
(3)上述流程中設計A→B步驟的目的是_________________________________。
(4)A與足量氫氧化鈉溶液反應的方程式為:_________________________________。
(5)A的同分異構體X滿足下列條件:
Ⅰ.能與NaHCO3反應放出氣體; Ⅱ.能與FeCl3溶液發生顯色反應。
符合上述條件的同分異構體有______種。其中核磁共振氫譜有5組吸收峰的結構簡式為_____________。
(6)參照上述合成路線和信息,以乙醛為原料(無機試劑任選),設計制
的合成路線:____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質轉化在給定條件下不能實現的是
A. Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 無水FeCl3
無水FeCl3
B. Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() AlCl3(aq)
AlCl3(aq)
C. NH3![]() NO
NO![]() HNO3
HNO3
D. SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3
Na2SiO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第三代半導體材料氮化鎵(GaN)適合于制作高溫、高頻、抗輻射及大功率器件,通常稱為高溫半導體材料。回答下列問題:
(1)基態Ga原子價層電子的軌道表達式為_________________________,第一電離能介于N和B之間的第二周期元素有_______種。
(2)HCN分子中σ鍵與π鍵的數目之比為_______,其中σ鍵的對稱方式為___________。與CN—互為等電子體的分子為___________。
(3)NaN3是汽車安全氣囊中的主要化學成分,其中陰離子中心原子的雜化軌道類型為_________。NF3的空間構型為____________。
(4)GaN、GaP、GaAs都是很好的半導體材料,晶體類型與晶體硅類似,熔點如下表所示,分析其變化原因_________________________________________________________。
GaN | GaP | GaAs | |
熔點 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞結構如下圖所示。已知六棱柱底邊邊長為a cm,阿伏加德羅常數的值為NA。


① 晶胞中Ga原子采用六方最密堆積方式,每個Ga原子周圍距離最近的Ga原子數目為_____________;
② GaN的密度為______________________g·cm3(用a、NA表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:① NO + NO2 + 2NaOH![]() 2NaNO2 + H2O;
2NaNO2 + H2O;
② 2NO2 + 2NaOH![]() NaNO3 + NaNO2 + H2O
NaNO3 + NaNO2 + H2O
將51.2 g Cu溶于一定濃度的硝酸中,若生成的氣體只含有NO、NO2,且這些氣體恰好被500 mL2.0 mol/L的NaOH溶液完全吸收,得到只含NaNO2和NaNO3的溶液。求:氣體中NO、NO2的物質的量分別為多少?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮氧化物能形成酸雨和光化學煙霧,嚴重污染環境。燃煤和機動車尾氣是氮氧化物的主要來源。現在對其中的一些氣體進行了一定的研究:
(1)用CH4催化還原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
寫出CH4(g)與NO2(g)反應生成N2(g)、CO2(g)和H2O(g)的熱化學方程式______________________________________________________。
(2)在汽車尾氣排氣管口采用催化劑將NO和CO轉化成無污染氣體。T℃時,將等物質的量的NO和CO充入容積為2 L的密閉容器中,保持溫度和體積不變,在一定條件下發生反應,反應過程中NO的物質的量隨時間變化如圖所示。

①寫出該反應的化學方程式______________________________________。
②10 min內該反應的速率v(CO)=__________________;T℃時,該化學反應的平衡常數K=_______。
③若該反應△H<0,在恒容的密閉容器中,反應達平衡后,改變某一條件,下列示意圖正確的是____________。(填序號)

④一定溫度下,在恒容密閉容器中充入一定量NO和CO進行該反應,下列選項能判斷反應已達到化學平衡狀態的是____________。
A.容器中壓強不再變化 B.混合氣體的平均相對分子質量不再變化
C.2v正(NO)=v逆(N2) D.氣體的密度不再變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能證明苯酚具有弱酸性的實驗是( )
A.加入濃溴水生成白色沉淀
B.苯酚的水溶液中加 NaOH溶液,生成苯酚鈉
C.苯酚的渾濁液加熱后變澄清
D.苯酚鈉溶液中通入CO2后,溶液由澄清變渾濁
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com