
(15分)隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%。目前,消除大氣污染有多種方法。
(1)用CH4催化還原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
寫出CH4(g)與NO2(g)反應生成N2 (g)、CO2 (g)和H2O(1)的熱化學方程式 。
(2)利用Fe2+、Fe3+的催化作用,常溫下可將SO2轉化為SO42-,從而實現對SO2的治理。已知含SO2的廢氣通入含Fe2+、Fe3+的溶液時,其中一個反應的離子方程式為4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,則另一反應的離子方程式為 。
(3)用活性炭還原法處理氮氧化物。有關反應為:C(s)+2NO(g) N2(g)+CO2(g)。某研究小組向密閉的真空容器中(假設容器體積不變,固體試樣體積忽略不計)加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
N2(g)+CO2(g)。某研究小組向密閉的真空容器中(假設容器體積不變,固體試樣體積忽略不計)加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
濃度/mol·L-1
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
(1) CH4(g)+2NO2(g)=N2(g) + CO2(g) +2H2O(l);⊿H= -955 kJ·mol-1(2分)
(2) 2Fe3+ + SO2+ 2H2O=2Fe2++SO42-+4H+ (2分) (3) ① 0.009 mol·L-1·min-1(2分)
②K=0.56(2分) ③不變(2分) ④C、D (2分) ⑤減小 CO2的濃度 (1分)
作圖要點:(2分)①起點在30min時V逆(CO 2)的一半左右 ②終點不超過30min時V逆(CO 2)
解析試題分析:(1)根據熱化學方程式①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1、②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1、③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1,依據蓋斯定律可知(①+②)× +③×2即得到反應CH4(g)+2NO2(g)=N2(g) + CO2(g) +2H2O(l),則該反應的反應熱△H=(-574 kJ·mol-1-1160 kJ·mol-1)×
+③×2即得到反應CH4(g)+2NO2(g)=N2(g) + CO2(g) +2H2O(l),則該反應的反應熱△H=(-574 kJ·mol-1-1160 kJ·mol-1)× -44.0 kJ·mol-1×2=-955 kJ·mol-1。
-44.0 kJ·mol-1×2=-955 kJ·mol-1。
(2)根據方程式4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O可知,反應中有鐵離子生成。而鐵離子具有氧化性,能把SO2氧化生成硫酸,因此另一個反應的離子方程式為2Fe3+ + SO2+ 2H2O=2Fe2++SO42-+4H+。
(3)①根據表中數據可知,10min~20min內CO2的濃度變化量=0.30mol/L-0.21mol/L=0.09mol/L,因此以v(CO2)表示的反應速率v(CO2)= =0.009 mol·L-1·min-1。
=0.009 mol·L-1·min-1。
②根據表中數據可知,反應進行到20min時各物質的濃度不再發生變化,此時反應達到平衡狀態,則根據平衡常數表達式K= =
=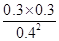 =0.56。
=0.56。
③根據方程式可知,該反應前后體積不變,且反應物只有NO是氣體。因此改變NO的起始濃度相當于改變壓強,平衡不移動,所以NO的轉化率不變。
④在一定條件下,當可逆反應的正反應速率和逆反應速率相等時(但不為0),反應體系中各種物質的濃度或含量不再發生變化的狀態,稱為化學平衡狀態,據此可以判斷。A、該反應前后體積不變,因此壓強始終是不變的,所以容器內壓強保持不變不能作為判斷的依據,A不正確;B、根據方程式并依據反應速率之比是相應的化學計量數之比可知2v正(NO)=2×2v正(N2)=v逆(N2),所以氮氣的正逆反應速率不相等,B不正確;C、容器內CO2的體積分數不變說明正反應速率相等,達到平衡狀態,C正確;D、密度度是混合氣的質量和容器容積的比值,在反應過程中容積始終是不變的,但混合氣的質量是變化的,因此當混合氣體的密度保持不變時說明混合氣的質量不再發生變化,可以說明反應達到平衡狀態,D正確,答案選CD。
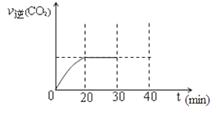
⑤根據表中數據可知,反應從30min~40min時NO的濃度減小,氮氣的濃度增大,而CO2的濃度減小,因此改變的條件應該是減小了CO2的濃度;30min后降低了CO2的濃度,平衡向正反應方向移動,但最終平衡時CO的濃度仍然比原平衡時小,所以此時的圖像可表示為 。
。
考點:考查熱化學方程式的書寫、氧化還原反應的應用;反應速率和平衡常數計算、外界條件對平衡狀態的影響、平衡狀態的判斷以及圖像作圖


科目:高中化學 來源: 題型:填空題
已知反應①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常數為K;反應②CO(g)+1/2O2(g)
FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常數為K;反應②CO(g)+1/2O2(g) CO2(g) ΔH="b" kJ·mol-1;反應③Fe2O3(s)+3CO(g)
CO2(g) ΔH="b" kJ·mol-1;反應③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。測得在不同溫度下,K值如下:
2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。測得在不同溫度下,K值如下:
| 溫度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。 查看答案和解析>>
科目:高中化學 來源: 題型:填空題
汽車尾氣中NOx的消除及無害化處理引起社會廣泛關注。
(1)某興趣小組查閱文獻獲得如下信息:
N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(g)) △H=―483.6kJ/mol
則反應2H2(g)+2NO(g)=2H2O(g)+N2(g) △H= 。
(2)該小組利用電解原理設計了如圖1裝置進行H2還原NO的實驗[高質子導電性的SCY陶瓷(能傳遞H+)為介質,金屬鈀薄膜做電極]。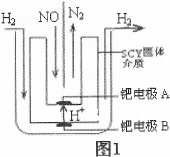
鈀電極A為 極,電極反應式為 。
(3)氨法催化還原NO原理如下:
主反應:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0)
副反應:4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
4NH3(g)+ 4O2(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g)
4NO(g)+4NH3(g)+3O2(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
有關實驗結論如圖2、圖3所示,據此回答以下問題: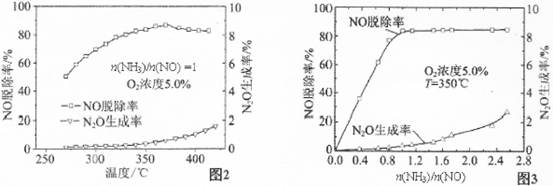
①催化還原NO應控制n(NH3)/n(NO)的最佳值為 ,理由是 。
②主反應平衡常數表達式:K= ,隨著溫度的增加,K將 (選填“增加”、 “減小”或“不變”。
③影響N2O生成率的因素有 、氧氣濃度和 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氮是一種地球上含量豐富的元素,氮及其化合物的研究在生產、生活中有著重要意義。
(1)下圖是1 mol NO2和1 mol CO反應生成CO2和NO過程中能量變化示意圖,寫出NO2和CO反應的熱化學方程式 。
(2)已知:N2(g)+ O2(g)=2 NO(g) △H=+180 kJ ? mol-1
2NO(g)+2 CO(g)=N2(g) + 2 CO2(g) △H=-746 kJ ? mol-1
則反應CO(g) + O2(g)=CO2(g)的 △H= kJ ? mol-1。
O2(g)=CO2(g)的 △H= kJ ? mol-1。
(3)在一固定容積為2L的密閉容器內加入0.2 mol的N2和0.6 mol的H2,在一定條件下發生如下反應: N2(g)+3H2(g) 2NH3(g) △H <0, 若第5分鐘時達到平衡,此時測得NH3的物質的量為0.2 mol,平衡時H2的轉化率為 。
2NH3(g) △H <0, 若第5分鐘時達到平衡,此時測得NH3的物質的量為0.2 mol,平衡時H2的轉化率為 。
(4)在固定體積的密閉容器中,1.0×103 kPa時,發生反應 N2(g)+3H2(g) 2NH3(g) △H<0,其平衡常數K與溫度T的關系如下表:
2NH3(g) △H<0,其平衡常數K與溫度T的關系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常數K | 51 | K1 | K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
一定條件下發生反應:CO(g)+2H2(g) CH3OH(g)。工業上依此用CO生產燃料甲醇。
CH3OH(g)。工業上依此用CO生產燃料甲醇。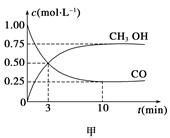
(1)甲圖是反應時CO和CH3OH(g)的濃度隨時間變化情況。從反應開始到平衡,用H2濃度變化表示平均反應速率v(CO)=__________________。
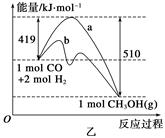
(2)乙圖表示該反應進行過程中能量的變化。曲線b下的反應條件為 。該反應的焓變是________(填“ΔH<0”或“ΔH>0”),寫出反應的熱化學方程式:____________________________________;選擇適宜的催化劑__________(填“能”或“不能”)改變該反應的反應熱。
(3)該反應平衡常數K的表達式為_____________________________________________,
溫度升高,平衡常數K________(填“增大”、“不變”或“減小”)。
(4)恒容條件下,下列措施中能使 增大的有____________。
增大的有____________。
a.降低溫度
b.充入He氣
c.再充入1 mol CO和2 mol H2
d.使用催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
“富煤、貧油、少氣”是我國能源發展面臨的現狀。隨著能源的日益緊張,發展“煤化工”對我國能源結構的調整具有重要意義。下圖是煤化工產業鏈之一。
“潔凈煤技術”研究在世界上相當普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續產出熱值很高的煤炭合成氣,其主要成分是CO和H2。CO和H2可作為能源和化工原料,應用十分廣泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol–1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ·mol–1 ②
則反應CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _________kJ·mol–1。在標準狀況下,33.6 L的煤炭合成氣(設全部為CO和H2)與氧氣完全反應生成CO2和H2O,反應中轉移______mole-。
(2)在一恒容的密閉容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形能說明上述反應已達到平衡狀態的是_______
a.體系壓強保持不變
b.密閉容器中CO、H2、CH3OH(g)3種氣體共存
c.CH3OH與H2物質的量之比為1:2
d.每消耗1 mol CO的同時生成2molH2
②CO的平衡轉化率(α)與溫度、壓強的關系如圖所示。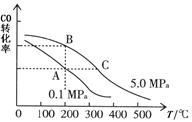
A、B兩點的平衡常數_____(填“前者”、“后者”或“一樣”)大;達到A、C兩點的平衡狀態所需的時間tA tC(填“大于”、“小于”或“等于”)。
在不改變反應物用量的情況下,為提高CO的轉化率可采取的措施是_____________(答出兩點即可)。
(3)工作溫度650℃的熔融鹽燃料電池,是用煤炭氣(CO、H2)作負極燃氣,空氣與CO2的混合氣體為正極燃氣,用一定比例的Li2CO3和Na2CO3低熔點混合物做電解質,以金屬鎳(燃料極)為催化劑制成的。負極的電極反應式為:CO + H2-4e- + 2CO32-= 3CO2+H2O;則該電池的正極反應式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
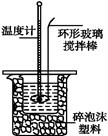
某實驗小組用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液進行中和熱的測定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若實驗中大約要使用245 mL NaOH溶液,至少需要稱量NaOH固體 g。
(2)從下圖中選擇稱量NaOH固體所需要的儀器是(填字母): 。
| 名稱 | 托盤天平 (帶砝碼) | 小燒杯 | 坩堝鉗 | 玻璃棒 | 藥匙 | 量筒 |
| 儀器 |  |  |  |  |  |  |
| 序號 | a | b | c | d | e | f |
| 溫度 實驗次數 | 起始溫度t1/℃ | 終止溫度t2/℃ | 溫度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%。目前,消除大氣污染有多種方法。
(1)處理NOx的一種方法是利用甲烷催化還原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
則甲烷直接將NO2還原為N2的熱化學方程為 。
(2)降低汽車尾氣的方法之一是在排氣管上安裝催化 轉化器,發生如下反應:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。
若在一定溫度下,將2molNO、1molCO充入1L固定容積的容器中,反應過程中各物質的濃度變化如圖所示,該反應的化學平衡常數為K= 。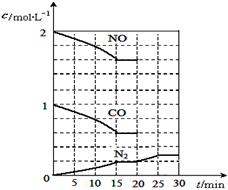
若保持溫度不變,20min時再向容器中充入CO、N2各0.6mol,平衡將 移動(填“向左”、 “向右”或“不”)。
20min時,若改變反應條件,導致N2濃度發生如上圖所示的變化,則改變的條件可能是 (填序號)。
①加入催化劑 ②降低溫度 ③縮小容器體積 ④增加CO2的量
(3)肼(N2H4)用亞硝酸(HNO2)氧化可生成氮的另一種氫化物,該氫化物的相對分子質量為43.0,其中氮原子的質量分數為0.977。寫出肼與亞硝酸反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
“潔凈煤技術”研究在世界上相當普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續產出了熱值高達122500~16000 kJ·m-3的煤炭氣,其主要成分是CO和H2。CO和H2可作為能源和化工原料,應用十分廣泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
則反應CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。標準狀況下的煤炭氣(CO、H2)33.6 L與氧氣完全反應生成CO2和H2O,反應過程中轉移 mol e-。
(2)密閉容器中充有10 mol CO與20 mol H2,在催化劑作用下反應生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡轉化率(α)與溫度、壓強的關系如圖所示。
CH3OH(g);CO的平衡轉化率(α)與溫度、壓強的關系如圖所示。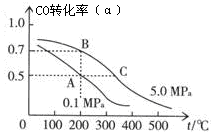
①若A、B兩點表示在某時刻達到的平衡狀態,此時在A點時容器的體積為VAL,則該溫度下的平衡常數K= ;A、B兩點時容器中物質的物質的量之比為n(A)總:n(B)總= 。
②若A、C兩點都表示達到的平衡狀態,則自反應開始到達平衡狀態所需的時間tA tC(填“大于”、“小于”或“等于”)。
③在不改變反應物用量的情況下,為提高CO的轉化率可采取的措施是 。
A.降溫 B.加壓 C.使用催化劑 D.將甲醇從混合體系中分離出來
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com