
【題目】現有mg某氣體,它由四原子分子構成,它的摩爾質量為Mg/mol.則:
(1)該氣體的物質的量為________mol。
(2)該氣體中所含的原子總數約為___________________個。
(3)該氣體在標準狀況下的體積為________L。
(4)該氣體溶于水后形成VL溶液,其溶液的物質的量濃度為________mol/L。
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】在中學化學中,KMnO4是常見的氧化劑之一。某實驗小組收集整理了相關知識:
(1) KMnO4中Mn的化合價為_______。
(2) 實驗室中可以加熱分解KMnO4制取O2,其反應方程式為_______________。
(3) 實驗中常在KMnO4溶液中加入適量稀硫酸,增加KMnO4的氧化性,但不宜用鹽酸酸化,因為濃度較大時,KMnO4可能將Cl-氧化成Cl2,該反應中氧化劑和還原劑的物質的量之比為:____________ ,比較以下兩種物質的氧化性:KMnO4_____________于Cl2(填“強”或“弱”)
(4) H2C2O4(草酸)是生物體的一種代謝產物,生活中常用作還原劑、除銹劑,將H2C2O4溶液滴入硫酸酸化的KMnO4溶液,當KMnO4被完全還原時,溶液顏色由_______變成無色,同時有無色氣體生成。該反應方程式為:_____________________。
(5)某同學將KMnO4溶液加入H2O2溶液,卻忘記了滴入稀硫酸,片刻后,有氣泡產生,且出現黑色沉淀。該沉淀化學式為____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃鐵礦(主要成分為FeS2)的利用對資源和環境具有重要意義。
(1)工業上煅燒黃鐵礦可制取SO2。已知下列熱化學方程式
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
則4Fe(s)+3O2(g)=2Fe2O3(s) △H=_____kJ/mol
(2)一種酸性條件下催化氧化黃鐵礦的物質轉化關系如圖I所示。
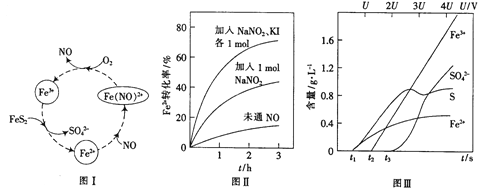
(1)寫出如圖中Fe3+與FeS2反應的離子方程式:______________。
(2)硝酸也可將FeS2氧化為Fe3+和SO42-,使用濃硝酸比使用稀硝酸反應速率慢,其原因是______________。
(3)控制Fe2+的濃度、溶液體積和通入O2的速率一定,圖II所示為改變其他條件時Fe2+被氧化的轉化率隨時間的變化。
① 加入NaNO2發生反應:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反應則轉移電子的數目為______mol。
② 加入NaNO2、KI發生反應:4H++2NO2-+2I-=2NO+I2+2H2O。解釋圖II中該條件下能進一步提高單位時間內Fe2+轉化率的原因:______________。
(4)為研究FeS2作電極時的放電規律,以FeS2作陽極進行電解,由FeS2放電產生粒子的含量與時間、電壓(U)的關系如圖III所示。
①寫出t1至t2間FeS2所發生的電極反應式:__________。
②當電壓的值介于3U~4U之間,FeS2放電所得主要粒子為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應mA(s)+nB(g) ![]() eC(g)+fD(g),反應過程中,當其它條件不變時,C的百分含量(C%)與溫度(T)和壓強(P)的關系如下圖,下列敘述正確的是
eC(g)+fD(g),反應過程中,當其它條件不變時,C的百分含量(C%)與溫度(T)和壓強(P)的關系如下圖,下列敘述正確的是

A. 到平衡后,加入催化劑則C%增大
B. 化學方程式中n<e+f
C. 達到平衡后,若升溫,平衡左移
D. 達到平衡后,增加A的量有利于平衡向右移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組進行Fe(OH)3膠體的制備實驗并檢驗其相關性質。
(1)若將飽和FeCl3溶液分別滴入下列物質中,能形成膠體的是______________(填序號)。
A.冷水 B.沸水 C.NaOH濃溶液 D.NaCl濃溶液
(2)寫出制備Fe(OH)3膠體的化學反應方程式:________________。
(3)怎樣證明制得的物質是膠體?請簡述操作過程:__________________。
(4)取少量制得的膠體加入試管中,再加入少量(NH4)2SO4溶液,觀察到的現象是__________, 這種現象稱為膠體的________________。
(5)Fe(OH)3膠體能穩定存在的主要原因是________(填序號)。
A. 膠粒直徑小于1nm B. 膠粒帶正電荷
C. 膠粒作布朗運動 D . 膠粒能透過濾紙
(6)Fe(OH)3膠體區別于FeCl3溶液最本質的特征是________(填序號)。
A. Fe(OH)3膠體粒子的直徑在1~100nm之間
B. Fe(OH)3膠體具有丁達爾效應
C. Fe(OH)3膠體是均一的分散系
D. Fe(OH)3膠體的分散質粒子能透過濾紙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在含Fe3+的S2O82-和I-的混合溶液中,反應S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解機理及反應進程中的能量變化如圖:
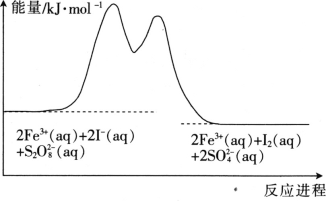
步驟①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步驟②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有關該反應的說法正確的是
A. 反應速率與Fe3+濃度有關
B. Fe2+是該反應的催化劑
C. v(S2O82-)=v(I-)=v(I2)
D. 若不加Fe3+,則正反應的活化能比逆反應的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可以利用如圖所示裝置制備氯氣,回答下列問題:
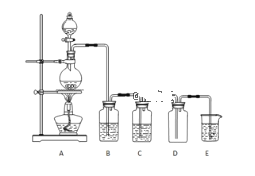
(1)分液漏斗中為濃鹽酸,燒瓶中是二氧化錳固體,寫出制取氯氣的化學方程式___。
(2)E中發生的化學反應方程式___。
(3)B中盛放的試劑是___。
(4)C中試劑的作用___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組進行了有關Cu、硝酸、硫酸化學性質的實驗,實驗過程如下圖所示。下列有關說法正確的是
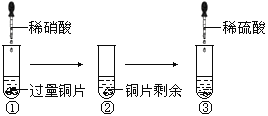
A. 實驗①中溶液呈藍色,試管口有紅棕色氣體產生,說明稀硝酸被Cu還原為NO2
B. 實驗③中滴加稀硫酸,銅片繼續溶解,說明稀硫酸的氧化性比稀硝酸強
C. 實驗③發生反應的化學方程式為:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述實驗可得出結論:Cu在常溫下既可以和稀硝酸反應,也可以和稀硫酸反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)13.8g氮的氧化物(NOx)中含N原子數為0.3mol,則NOx的摩爾質量為___,x的數值為___,該質量的NOx在標準狀況下的體積為___L。
(2)某待測液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等離子,進行如下實驗:① 加入過量的稀鹽酸,有白色沉淀生成;② 過濾,得無色透明溶液,在濾液中加入過量的稀硫酸,又有白色沉淀生成;③ 過濾,取少量濾液,加入NaOH溶液至溶液呈堿性,加熱,可產生使濕潤的紅色石蕊試紙變藍色的氣體。
根據實驗現象回答:待測液中一定含有___離子;—定不含有__離子;還有____離子不能確定是否存在,要檢驗這些離子的實驗方法是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com