
【題目】聚酯纖維F 和維綸J的合成路線如下:
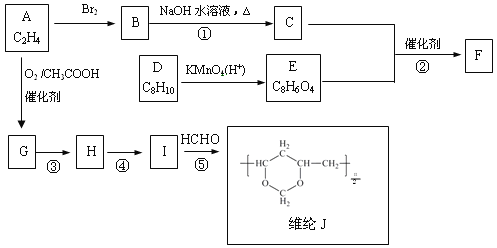
已知:
1.乙烯醇不穩定,會迅速轉化為乙醛
2.CH2=CH2 +1/2O2 + CH3COOH![]() CH2=CHOOCCH3 + H2O
CH2=CHOOCCH3 + H2O
3 . +H2O
+H2O
(1)G中官能團的名稱是
(2)C的結構簡式是
(3)芳香烴D的一氯代物只有兩種,則D的結構簡式是
(4)反應③的反應類型是
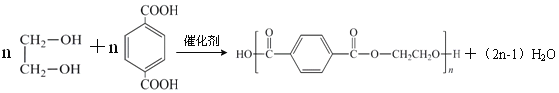
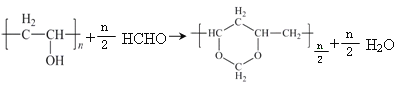
(5)反應②和⑤的化學方程式分別是:
反應②
反應⑤
(6)已知:![]() 。E也可由A和2,4-己二烯為原料制備,請寫出該合成路線(無機試劑任選)。
。E也可由A和2,4-己二烯為原料制備,請寫出該合成路線(無機試劑任選)。
【答案】
(1)碳碳雙鍵,酯基;(2)![]() ;(3)
;(3)![]() ;(4)加聚
;(4)加聚
(5)
(6)![]() +CH2=CH2
+CH2=CH2![]()
![]()
![]()
![]()
![]()
![]() 。
。
【解析】
試題分析:A(乙烯)與溴加成生成B,B為1,2-二溴乙烷,B在氫氧化鈉溶液中水解生成C,C為乙二醇;根據信息②,乙烯在乙酸存在時氧化生成G,G為CH2=CHOOCCH3,根據維綸的結構,結合信息③,I為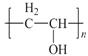 ,則H為CH2=CHOH。根據芳香烴D的一氯代物只有兩種,D的結構簡式為
,則H為CH2=CHOH。根據芳香烴D的一氯代物只有兩種,D的結構簡式為![]() ,D在高錳酸鉀溶液中氧化生成對二苯甲酸,與乙二醇發生聚合反應生成F,F為
,D在高錳酸鉀溶液中氧化生成對二苯甲酸,與乙二醇發生聚合反應生成F,F為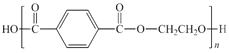 。
。
(1)G為CH2=CHOOCCH3,其中的官能團有碳碳雙鍵,酯基,故答案為:碳碳雙鍵,酯基;
(2)C為乙二醇,結構簡式為![]() ,故答案為:
,故答案為:![]() ;
;
(3)芳香烴D的化學式為C8H10,一氯代物只有兩種,D的結構簡式為![]() ,故答案為:
,故答案為:![]() ;
;
(4)根據上述分析,反應③是加聚反應,故答案為:加聚;
(5)反應②的化學方程式為 ,反應⑤的化學方程式為
,反應⑤的化學方程式為 ,故答案為:
,故答案為: ;
; ;
;
(6)由乙烯和2,4-己二烯為原料制備![]() , 2,4-己二烯與乙烯反應生成
, 2,4-己二烯與乙烯反應生成![]() ,根據信息
,根據信息![]() ,可知
,可知![]() 可以轉化為對二甲苯,再氧化即可,合成路線為:
可以轉化為對二甲苯,再氧化即可,合成路線為:![]() +CH2=CH2
+CH2=CH2![]()
![]()
![]()
![]()
![]()
![]() ,故答案為:
,故答案為:![]() +CH2=CH2
+CH2=CH2![]()
![]()
![]()
![]()
![]()
![]() 。
。


 黃岡創優卷系列答案
黃岡創優卷系列答案科目:高中化學 來源: 題型:
【題目】據某科學雜志報道,國外有一研究發現了一種新的球形分子,它的分子式為C60Si60,其分子結構好似中國傳統工藝品“鏤雕”,經測定其中包含C60,也有Si60結構。下列敘述正確的是 ( )
A. 該物質有很高的熔點、很大的硬度 B. 該物質形成的晶體屬于分子晶體
C. 該物質分子中Si60被包裹在C60里面 D. 該物質的相對分子質量為1200
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,在溶液中可發生以下反應:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判斷下列說法錯誤的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判斷下列說法錯誤的是( )
A.氧化性強弱順序為:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.還原性強弱順序為:X2+<Z-<R-<M2+
C.Z元素在反應①中被氧化,在③中被還原
D.常溫下可發生反應2M2++Z2===2M3++2Z-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是(NA為阿伏加德羅常數的值)( )
A.28 g氮氣含有的原子數為NA
B.4 g金屬鈣變成鈣離子時失去的電子數為0.1NA
C.1 mol O2分子的質量等于1 mol氧原子的質量
D.24 g O2分子和24 g O3分子所含的氧原子數目相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種有機物的結構簡式如下圖,關于它的性質不正確的說法是( )
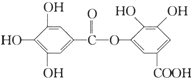
A.它有酸性,1 mol該物質最多能與6 mol H2發生加成反應
B.它可以水解,水解產物為兩種有機物
C.在一定條件下,1 mol該物質最多能和8 mol NaOH反應
D.該有機物能發生取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)用Cl2生產某些含氯有機物時會產生副產物HCl。
利用反應A可實現氯的循環利用。反應A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此條件下反應A中,4 mol HCl被氧化,放出115.6 kJ的熱量。
ⅱ.![]()
![]()
①寫出此條件下,反應A的熱化學方程式 。
②斷開1 mol H—O鍵與斷開1 mol H—Cl鍵所需能量相差約為 kJ。
(2)氫氣用于工業合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
①一定溫度下,在容積恒定的密閉容器中,一定量的N2和H2反應達到平衡后,改變某一外界條件,正逆反應速率與時間的關系如下圖所示,其中t4 ﹑t5 ﹑t7時刻對應的實驗條件改變分別是t4 ;t5 ;t7 。
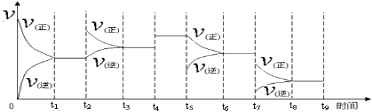
②溫度為T℃時,將2nmolH2和nmolN2放入0.5L密閉容器中,充分反應后測得N2的轉化率為50﹪,此時放出熱量46.1 kJ。則n= 。
(3)科學家用氮化鎵材料與銅組裝如圖的人工光合系統,利用該裝置成功地實現了以CO2和H2O合成CH4。
①寫出銅電極表面的電極反應式 。
②為提高該人工光合系統的工作效率,可向裝置中加入少量 (選填“氫氧化鈉”或“硫酸”)。
(4)傳統制備肼的方法是以NaClO氧化NH3,制得肼(N2H4)的稀溶液。該反應的離子方程式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于粗鹽提純的說法中正確的是( )
A.溶解粗鹽時,應盡量讓溶液稀些,防止食鹽不完全溶解
B.濾去不溶性雜質后,將濾液移至坩堝內加熱濃縮
C.當蒸發到剩余少量液體時,停止加熱,利用余熱將液體蒸干
D.將制得的晶體轉移到新制過濾器中用大量水進行洗滌
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯堿廠電解飽和食鹽水制取NaOH的工藝流程示意圖如下:
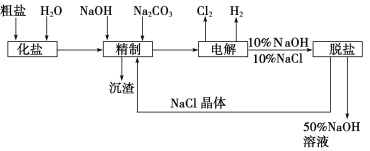
依據上圖,完成下列填空:
(1)在電解過程中,與電源正極相連的電極上所發生反應的電極反應式為_________________,與電源負極相連的電極附近,溶液pH________(選填“不變”、“升高”或“下降”)。
(2)工業食鹽中含Ca2+、Mg2+等雜質,精制過程中除去這些雜質時發生反應的離子方程式為__________________、__________________。
(3)如果粗鹽中SO42-含量過高,必須添加鋇試劑除去SO42-,該鋇試劑可以是________(填寫字母序號,下同)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)為有效除去Ca2+、Mg2+、SO42-,加入試劑的合理順序為________。
A.先加NaOH,后加Na2CO3,再加鋇試劑
B.先加NaOH,后加鋇試劑,再加Na2CO3
C.先加鋇試劑,后加NaOH,再加Na2CO3
(5)脫鹽工序中利用NaOH和NaCl在溶解度上的差異,通過________、冷卻、________(填寫操作名稱)除去NaCl。
(6)用隔膜法電解食鹽水時,電解槽分隔為陽極區和陰極區,防止Cl2與NaOH反應;采用無隔膜法電解冷的食鹽水時,Cl2與NaOH充分接觸,得到的產物僅是NaClO和H2,則與該反應相應的化學方程式為___________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com