
【題目】某同學設計如圖1所示裝置分別進行探究實驗(夾持裝置已略去),請回答下列問題:
實驗 | 藥品 | 制取氣體 | 量氣管中的液體 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | NaOH固體、濃氨水 | NH3 | |
Ⅲ | Na2SO3固體、濃H2SO4 | SO2 | |
Ⅳ | 鎂鋁合金、NaOH溶液(足量) | H2 | H2O |
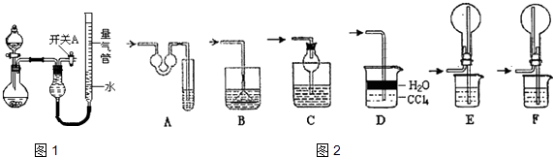
(1)實驗過程中,使用分液漏斗滴加液體的操作是 .
(2)該同學認為實驗I可通過收集并測量NO氣體的體積來探究銅樣品的純度,你認為是否可行?(填“可行”或“不可行”).原因為
(3)實驗Ⅲ燒瓶中產生的SO2氣體通入溴水溶液中發生反應的離子方程式是 .
(4)實驗Ⅱ中量氣管中的液體最好是(填字母編號,下同).
a.濃NaOH溶液 b.氨水 c.煤油 d.氯化銨溶液
該實驗剩余的NH3需吸收處理.如圖2,以下各種尾氣吸收裝置中,適合于吸收NH3 , 而且能防止倒吸的有 .
(5)本實驗應對量氣管多次讀數,讀數時應注意:①將實驗裝置恢復到室溫,② , ③視線與凹液面最低處相平.
(6)實驗Ⅳ獲得以下數據(所有氣體體積已換算成標準狀況,忽略滴入液體體積對氣體體積的影響)
編號 | 鎂鋁合金度量 | 量氣管第一次讀數 | 量氣管第二次讀數 |
① | 1.0g | 10.0mL | 346.3mL |
② | 1.0g | 10.0mL | 335.0mL |
③ | 1.0g | 10.0mL | 345.7mL |
根據上述數據,可計算出鎂鋁合金中鋁的質量分數為 . (H:1 Mg:24 Al:27)
【答案】
(1)打開分液漏斗上口的活塞(或將活塞上的凹槽與瓶口上的小孔對齊),旋開分液漏斗的旋塞,緩慢滴加
(2)不可行;NO會與裝置中空氣反應,生成NO2溶于水,使測得的NO氣體體積不準
(3)SO2+Br2+2H2O=4H++2Br﹣+SO42﹣
(4)c;ACDF
(5)使量氣管兩端液面相平
(6)27.0%
【解析】解:(1.)分液漏斗用于氣體發生器中控制加液,也常用于互不相溶的幾種液體的分離,加液時要注意內外空氣相通,壓強相等,液體才能順利流下,具體操作為:打開分液漏斗上口的活塞(或將活塞上的凹槽與瓶口上的小孔對齊),旋開分液漏斗的旋塞,緩慢滴加,
所以答案是:打開分液漏斗上口的活塞(或將活塞上的凹槽與瓶口上的小孔對齊),旋開分液漏斗的旋塞,緩慢滴加;
(2.)一氧化氮與氧氣反應生成二氧化氮,二氧化氮可與水反應生成一氧化氮和硝酸;裝置Ⅰ中有空氣,一氧化氮會與裝置中的空氣反應,生成的二氧化氮溶于水并與水反應,使測得的一氧化氮體積不準,所以不可以通過實驗I收集并測量NO氣體的體積來探究銅樣品的純度,
所以答案是:不可行;NO會與裝置中空氣反應,生成NO2溶于水,使測得的NO氣體體積不準;
(3.)SO2氣體通入溴水溶液中發生反應生成硫酸和溴化氫,反應的離子方程式為SO2+Br2+2H2O=4H++2Br﹣+SO42﹣ ,
所以答案是:SO2+Br2+2H2O=4H++2Br﹣+SO42﹣;
(4.)氨氣為堿性氣體,極易溶于水,量氣管中的液體應該不含水且不與氨氣反應,濃NaOH溶液、氨水、氯化銨溶液中含有水,氨氣被水吸收,而氨氣不溶于煤油,所以量氣管中液體最好是煤油,故選c;
A.對于極易溶于水的氣體,吸收裝置中的導管外聯雙球狀導管內伸入到液體中,液體進入雙球內,防止進入前端裝置,能防止倒吸;故A正確;
B.吸收裝置中的導管下聯漏斗,漏斗口伸入液面以下,易吸收易溶性氣體,不能防止倒吸;故B不正確;
C.對于極易溶于水的氣體,吸收裝置中的導管與干燥管連接,當水進入干燥管內,燒杯內液面下降低于導管口,液體又流落到燒杯中,能防止倒吸,故C正確.
D.氨氣極易溶于水,不溶于四氯化碳,所以導管通入四氯化碳中,氣泡向上到水層溶解,能防止倒吸,故D正確;
E.氨氣極易溶于水,導管插入溶液中形成噴泉,進氣管在燒瓶口,液體經進氣管倒流入前端裝置,產生倒吸,故E錯誤;
F.氨氣極易溶于水,導管插入溶液中形成噴泉,進氣管在燒瓶底部,液體不能流入前端裝置,能防止倒吸,故F正確;
所以能防倒吸的吸收裝置有ACDF,
所以答案是:c;ACDF;
(5.)根據PV=nRT,為保證測出來的氣體體積是當時大氣壓下的體積,在讀數時應注意:①將實驗裝置恢復到室溫,②使量氣管兩端液面相平,因為相平說明兩邊液面上的壓強是一樣的,這樣測出來的氣體體積才是當時大氣壓下的體積,③視線與凹液面最低處相平,俯視或仰視會造成誤差,
所以答案是:使量氣管兩端液面相平;
(6.)第2次測量數據誤差較大,可不用,鋁和氫氧化鈉反應生成氫氣的體積= ![]() =336.0mL=0.336L
=336.0mL=0.336L
設生成0.336L氫氣,需鋁的質量為x
2Al | + | 2NaOH | + | 2H2O | ═ | 2NaAlO2 | + | 3H2↑ |
54g | 3×22.4L | |||||||
x | 0.336L |
![]() =
= ![]() ,解之得:x=0.27g
,解之得:x=0.27g
鋁的質量分數= ![]() =27.0%,
=27.0%,
所以答案是:27.0%.


 挑戰100單元檢測試卷系列答案
挑戰100單元檢測試卷系列答案科目:高中化學 來源: 題型:
【題目】物質的量濃度相同的NaCl 、MgCl2、AlCl3三種溶液,當溶液的體積比為3:2:1時,三種溶液中Cl-的物質的量之比為( )
A 1:1:1 B 1:2:3 C 3:2:1 D 3:4:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同分異構現象是造成有機物種類繁多的重要原因之一。下列各組物質互為同分異構體的是
A.甲烷與丙烷B.CH2=CH2與CH3CH3C.蔗糖與麥芽糖D.纖維素與淀粉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.放熱反應均是自發反應
B.△S為正值的反應均是自發反應
C.物質的量增加的反應,△S為正值
D.如果△H和△S均為正值,當溫度升高時,反應可能自發進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫及其化合物對人類的生產和生活有著重要的作用.
2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1是制備硫酸的重要反應.
(1)在容積為V L的密閉容器中起始充入2mol SO2和1mol O2 , 反應在不同條件下進行,反應體系總壓強隨時間的變化如下圖所示.與實驗a相比,實驗b改變的條件是 , 判斷的依據 . 
(2)二氧化硫在一定條件下還可以發生如下反應:
SO2(g)+NO2(g)SO3(g)+NO(g)△H=﹣42kJmol﹣1 .
在1L恒容密閉容器中充入SO2(g)和NO2(g),所得實驗數據如下:
實驗編號 | 溫度 | 起始時物質的量/mol | 平衡時物質的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①實驗甲中,若2min時測得放出的熱量是4.2kJ,則0~2min時間內,用SO2(g)表示的平均反應速率v(SO2)= , 該溫度下的平衡常數 .
②實驗丙中,達到平衡時,NO2的轉化率為 .
③由表中數據可推知,TlT2(填“>”“<’’或“=”),判斷的理由是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣燃燒生成液態水的熱化學方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。請回答下列問題:
(1)生成物能量總和________(填“大于”“小于”或“等于”)反應物能量總和。
(2)若2 mol氫氣燃燒生成水蒸氣,則放出的熱量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的標準燃燒熱ΔH=________。
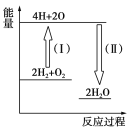
(4)反應2H2+O2![]() 2H2O的能量變化如圖所示。
2H2O的能量變化如圖所示。
已知拆開1 mol H2、1 molO2和1 mol H—O中的化學鍵分別需要消耗436 kJ、496 kJ和463 kJ的能量。
則反應過程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用蓋斯定律可方便地計算出難以通過實驗直接測定的反應熱。
已知:①P4(白磷,s)+5O2(g)![]() P4O10(s) ΔH=2 983.2 kJ·mol1
P4O10(s) ΔH=2 983.2 kJ·mol1
②P(紅磷,s)+![]() O2(g)
O2(g)![]()
![]() P4O10(s) ΔH=738.5 kJ·mol1
P4O10(s) ΔH=738.5 kJ·mol1
則白磷轉化為紅磷的熱化學方程式為
A.P4(白磷,s)![]() 4P(紅磷,s) ΔH=29.2 kJ·mol1
4P(紅磷,s) ΔH=29.2 kJ·mol1
B.P4(白磷,s)![]() 4P(紅磷,s) ΔH=+29.2 kJ·mol1
4P(紅磷,s) ΔH=+29.2 kJ·mol1
C.P4(白磷,s)![]() 4P(紅磷,s) ΔH=2 244.7 kJ·mol1
4P(紅磷,s) ΔH=2 244.7 kJ·mol1
D.P4(白磷,s)![]() 4P(紅磷,s) ΔH=+2244.7 kJ·mol1
4P(紅磷,s) ΔH=+2244.7 kJ·mol1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值,下列物質所含粒子數為0.2NA的是( )
①標準狀況下,2.24L Cl2中含有的共價鍵數
②常溫下,2L pH=13的Na2CO3溶液中含有的OH﹣離子數
③100mL 1.0mo1L﹣1的NaAlO2溶液中含有的氧原子數
④標準狀況下,2.24L Cl2與足量的NaOH溶液反應時轉移的電子數
⑤3.2gO2和O3的混合氣體中含有的氧原子數
⑥3.9g Na2O2晶體中所含的離子總數.
A.②③⑥
B.②⑤
C.③⑤⑥
D.④⑥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com