
【題目】已知某溫度下CH3COOH和NH3·H2O的電離常數相等,現向10 mL濃度為0.1 mol·L-1的CH3COOH溶液中滴加相同濃度的氨水,在滴加過程中 ( )
A. 水的電離程度始終增大
B. c(NH4+)/c(NH3·H2O)先增大再減小
C. 當加入氨水的體積為10 mL時,c(NH4+)=c(CH3COO-)
D. c(CH3COOH)與c(CH3COO-)之和始終保持不變
【答案】C
【解析】
A.開始時,溶液的酸性逐漸減弱,水的電離程度逐漸增大;當氨水過量后,溶液中氫氧根離子濃度逐漸增大,水的電離程度逐漸減小;
B.根據一水合氨的電離平衡常數可知,該比值與氫氧根離子成反比,電離氨水的過程中,溶液中氫氧根離子濃度逐漸增大;
C.CH3COOH和NH3H2O的電離常數相等,氨水與醋酸的濃度、體積相等時,溶液顯中性,根據電荷守恒可知c(NH4+)=c(CH3COO-),;
D.根據物料守恒,醋酸和醋酸根離子的物質的量之和不變,但是溶液體積增大,二者的濃度之和逐漸減小。
A.酸溶液、堿溶液抑制水的電離,溶液顯示中性前,隨著氨水的加入,溶液中氫離子濃度逐漸減小,水的電離程度逐漸增大;當氨水過量后,隨著溶液中氫氧根離子濃度逐漸增大,水的電離程度又逐漸減小,所以在滴加氨水的過程中,水的電離程度先增大后減小,選項A錯誤;
B.當向CH3COOH溶液中滴加相同濃度的氨水,開始時溶液為CH3COOH和CH3COONH4的混合物,由一水合氨的電離平衡常數Kb=![]() 可知:隨著氨水的加入,c(H+)逐漸減小,c(OH-)逐漸增大,
可知:隨著氨水的加入,c(H+)逐漸減小,c(OH-)逐漸增大,![]() 逐漸減小,選項B錯誤;
逐漸減小,選項B錯誤;
C.當加入氨水的體積為10mL時,n(CH3COOH)=n(NH3H2O),由于二者的電離常數相等,所以溶液顯示中性,c(H+)= c(OH-),根據電荷守恒可知:c(NH4+)=c(CH3COO-),選項C正確;
D.n(CH3COOH)+n(CH3COO-)=0.001mol,始終保持不變,由于溶液體積逐漸增大,所以c(CH3COOH)與c(CH3COO-)之和逐漸減小,選項D錯誤;
故合理選項是C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】在一定條件下,將充滿 NO2 和 O2 的試管倒立于水槽中,充分反應后,剩余氣體體積為原混合氣體體積的![]() ,則原混合氣體中 NO2 和O2 的體積之比可能是( )
,則原混合氣體中 NO2 和O2 的體積之比可能是( )
①8∶1 ②7∶3 ③7∶1 ④4∶1
A.①②B.①③
C.②③D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】石蠟油(17個碳原子以上的液態烷烴混合物)的分解實驗裝置如圖所示(部分儀器已忽略)在試管①中加入石蠟油和氧化鋁(催化石蠟分解);試管②放在冷水中,試管③中加入溴水。實驗現象:試管①中加熱一段時間后,可以看到試管內液體沸騰;試管②中有少量液體凝結,聞到汽油的氣味,往液體中滴加幾滴高錳酸鉀酸性溶液顏色褪去。根據實驗現象回答下列問題:

(1)裝置A的作用是________
(2)試管①中發生的主要反應有:C8H18![]() C4H10+C4H8 C8H36
C4H10+C4H8 C8H36 ![]() C8H18+C9H18丁烷可進一步裂解,除得到甲烷和乙烷外,還可以得到另兩種有機物,它們的結構簡式為________和________,這兩種有機物混合后在一定條件下可聚合成高分子化合物,其反應類型屬于________反應。其可能結構為________(填字母,答案可能不止一個,下同)
C8H18+C9H18丁烷可進一步裂解,除得到甲烷和乙烷外,還可以得到另兩種有機物,它們的結構簡式為________和________,這兩種有機物混合后在一定條件下可聚合成高分子化合物,其反應類型屬于________反應。其可能結構為________(填字母,答案可能不止一個,下同)
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)寫出試管③中反應的任意一個化學方程式________________。
(4)試管②中的少量液體的組成是________(填序號)
①甲烷 ②乙烯 ③液態烷烴 ④液態烯烴。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳鎘(Ni—Cd)可充電電池在現代生活中有廣泛應用。已知某鎳鎘電池的電解質溶液為KOH溶液,其充、放電按下式進行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有關該電池的說法正確的是( )
Cd(OH)2+2Ni(OH)2。有關該電池的說法正確的是( )
A. 放電時負極附近溶液的堿性不變
B. 充電過程是化學能轉化為電能的過程
C. 充電時陽極反應:Ni(OH)2-e-+ OH-=NiOOH + H2O
D. 放電時電解質溶液中的OH-向正極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含氯化合物在工農業生產和日常生活中有著廣泛的用途。
(1)工業上用氯氣制備漂白粉,某研究小組利用下列裝置制備漂白粉。

①漂白粉的有效成分是_____________(填化學式)。漂白粉放置在空氣中一段時間后會失效,原因是(寫出有關反應的化學方程式)________________________。
②裝置A中發生反應的化學方程式為___________________________________。
③裝置B中試劑a為_________,作用是________________________________。
(2)ClO2常用于自來水的消毒、木質紙漿的漂白。已知:NaCl+3H2O![]() NaClO3+3H2↑,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。有關物質的熔、沸點如下表:
NaClO3+3H2↑,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。有關物質的熔、沸點如下表:
物質 | 熔點/℃ | 沸點/℃ |
ClO2 | -59 | 11 |
Cl2 | -107 | -34.6 |
ClO2的生產流程示意圖如下:

理論上每生成1molClO2,外界至少補充X氣體________ mol。從ClO2發生器中分離出ClO2可采用的方法是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH隨滴入HCl溶液體積的變化曲線如圖所示。下列說法正確的是

A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三點所示的溶液中水的電離程度②>③>①
D. 滴定過程中不可能出現:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下pH=11的X、Y兩種堿溶液各5 mL,分別稀釋至500 mL,其pH與溶液體積(V)的關系如圖所示,下列說法正確的是( )

A. 稀釋后X溶液中水的電離程度比Y溶液中水電離程度小
B. 若X為強堿,則a=9
C. 若X、Y都是弱堿,則a的值一定小于9
D. 完全中和X、Y兩溶液時,消耗同濃度稀硫酸的體積V(X)>V(Y)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫條件下,在體積不變的密閉容器中,有可逆反應X(s)+2Y(g) ![]() 2Z(g) △H<0,下列說法—定正確的是
2Z(g) △H<0,下列說法—定正確的是
A. 0.2molX和0.4molY充分反應,Z的物質的量可能會達到0.35mol
B. 從容器中移出部分反應物X,則正反應速率將下降
C. 當△H不變時,反應將達到平衡
D. 向反應體系中繼續通入足量Y氣體,X有可能被反應完全
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖均為電化學裝置,下列有關敘述正確的是( )
A.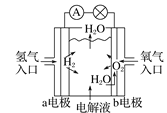 氫氧燃料電池示意圖中,b電極發生氧化反應
氫氧燃料電池示意圖中,b電極發生氧化反應
B. 電解氯化銅溶液裝置中,鐵棒上析出紅色固體
電解氯化銅溶液裝置中,鐵棒上析出紅色固體
C. 電鍍實驗裝置中,若電鍍前兩電極質量相等,電鍍完成后二者質量差為5.12 g,則電鍍時待鍍鐵制品應與電源負極相連,外電路轉移0.08 mol電子
電鍍實驗裝置中,若電鍍前兩電極質量相等,電鍍完成后二者質量差為5.12 g,則電鍍時待鍍鐵制品應與電源負極相連,外電路轉移0.08 mol電子
D. 交換膜法電解飽和NaCl溶液原理圖中,離子交換膜應為陰離子交換膜
交換膜法電解飽和NaCl溶液原理圖中,離子交換膜應為陰離子交換膜
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com