
【題目】下列各組中兩種微粒所含電子數(shù)不相等的是
A.H3O+和OHB.CO和N2
C.HNO2和![]() D.
D.![]() 和
和![]()
【答案】D
【解析】
粒子中質子數(shù)等于原子的質子數(shù)之和,中性微粒中質子數(shù)=電子數(shù),陽離子的電子數(shù)=質子數(shù)-電荷數(shù),陰離子的電子數(shù)=質子數(shù)+電荷數(shù)。
A項、H3O+的質子數(shù)為11,電子數(shù)為111=10,OH的質子數(shù)為9,電子數(shù)為9+1=10,電子數(shù)相等,故A正確;
B項、CO的質子數(shù)為14,電子數(shù)為14,N2的質子數(shù)為14,電子數(shù)為14,電子數(shù)相等,故B正確;
C項、HNO2的質子數(shù)為1+7+8×2=24,電子數(shù)為24,![]() 的質子數(shù)為7+8×2=23,電子數(shù)為23+1=24,電子數(shù)相等,故C正確;
的質子數(shù)為7+8×2=23,電子數(shù)為23+1=24,電子數(shù)相等,故C正確;
D項、![]()
![]() 的質子數(shù)為6+1×3=9,電子數(shù)為91=8,
的質子數(shù)為6+1×3=9,電子數(shù)為91=8,![]() 的質子數(shù)為11,電子數(shù)為111=10,電子數(shù)不相等,故D錯誤。
的質子數(shù)為11,電子數(shù)為111=10,電子數(shù)不相等,故D錯誤。
故選D。


科目:高中化學 來源: 題型:
【題目】下列能與文字表述對應且正確的反應方程式是( )
A.甲烷和氯氣在光照條件下反應: 2CH4+Cl2![]() 2CH3Cl +H2
2CH3Cl +H2
B.實驗室用電石制乙炔:CaC2+2H2O→Ca(OH)2+![]() ↑
↑
C.用NaOH溶液中和苯酚溶液的酸性:H++OH-=H2O
D.向苯酚鈉溶液中通入少量CO2:CO2+H2O+2C6H5O-→2 C6H5OH+ CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用![]() 表示原子:
表示原子:
(1)中性原子的中子數(shù):N=________。
(2)陽離子的中子數(shù):![]() 共有x個電子,則N=________。
共有x個電子,則N=________。
(3)陰離子的中子數(shù):![]() 共有x個電子,則N=________。
共有x個電子,則N=________。
(4)中性分子或原子團的中子數(shù):![]() 分子中,N=________。
分子中,N=________。
(5)A2-原子核內有x個中子,其質量數(shù)為m,則ng A2-所含電子的物質的量為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是![]()
![]()
①質子數(shù)相同的微粒一定屬于同一種元素![]()
②同位素的性質相同![]()
③質子數(shù)相同、電子數(shù)也相同的微粒,不可能是一種分子和一種離子![]()
④電子數(shù)相同的微粒不一定是同一種元素![]()
⑤一種元素只能有一種質量數(shù)![]()
⑥某種元素的相對原子質量取整數(shù),就是其質量數(shù)![]()
⑦![]() 中
中![]() 與
與![]() 的原子個數(shù)之比與NaCl中的
的原子個數(shù)之比與NaCl中的![]() 與
與![]() 的原子個數(shù)之比相等
的原子個數(shù)之比相等
A.②③⑤⑥⑦B.①②④⑤C.①②⑤⑥D.③④⑥⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是
①質子數(shù)相同的微粒一定屬于同一種元素
②同位素的性質幾乎相同
③質子數(shù)相同,電子數(shù)也相同的兩種微粒,不可能是一種分子和一種離子
④某種元素的相對原子質量取整數(shù),就是其質量數(shù)
⑤一種元素只能有一種質量數(shù)
⑥電子數(shù)相同的微粒不一定是同一種元素。
A.②③⑤⑥B.①②④⑤C.①②⑤⑥D.③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗能力和創(chuàng)新意識是化學學科核心素養(yǎng)的重要內容之一。某研究性學習小組在驗證反應“ Fe![]() ”的實驗中檢測到
”的實驗中檢測到![]() 發(fā)現(xiàn)和探究過程如下:向硝酸酸化的
發(fā)現(xiàn)和探究過程如下:向硝酸酸化的![]() 硝酸銀溶液(
硝酸銀溶液(![]() )中加入過量鐵粉,攪拌后靜置,燒杯底部有黑色固體,溶液呈黃色。
)中加入過量鐵粉,攪拌后靜置,燒杯底部有黑色固體,溶液呈黃色。
(1)檢驗產物:
①檢驗上層清液中所含離子的方法:取上層清液,滴加_________,產生藍色沉淀,說明溶液中含有Fe2+。
②經(jīng)檢驗黑色固體為Ag,檢驗方法:取出少量黑色固體,洗滌后,加入適量稀硝酸使固體溶解,再滴加__________(填試劑),產生_________(填現(xiàn)象)。
(2)針對“溶液呈黃色”,甲認為溶液中有![]() 乙認為鐵粉過量時不可能有
乙認為鐵粉過量時不可能有![]() ,乙依據(jù)的原理是______。(用離子方程式表示)o
,乙依據(jù)的原理是______。(用離子方程式表示)o
針對這兩種觀點繼續(xù)實驗:取上層清液,滴加KSCN溶液,溶液變紅,證實了甲的猜測。同時發(fā)現(xiàn)有白色沉淀產生,且溶液顏色深淺、沉淀量多少與取樣時間有關,對比實驗記錄如下:
序號 | 取樣時間/min | 現(xiàn)象 |
I | 3 | 產生大量白色沉淀;溶液呈紅色 |
II | 30 | 產生白色沉淀,較3 min時量少;溶液紅色較3 min時加深 |
III | 120 | 產生白色沉淀,較30min時量少;溶液紅色較30min時變淺 |
(資料: ![]() -生成白色沉淀AgSCN)
-生成白色沉淀AgSCN)
(3)實驗中溶液變?yōu)榧t色的離子方程式為_______________,產生白色沉淀說明存在___________(填離子符號)。
(4)對![]() 產生的原因做如下假設:
產生的原因做如下假設:
假設a:可能是鐵粉表面有氧化層,能產生![]()
假設b:空氣中存在![]() 發(fā)生反應
發(fā)生反應![]() 產生
產生![]()
假設c:酸性溶液中的NO3-將Fe2+氧化為Fe3+
假設d
下述實驗可證實假設a、b,c不是產生Fe3+的主要原因,并可證實假設d成立。
①實驗:向硝酸酸化的__________溶液( ![]() )中加入過量鐵粉,攪拌后靜置,不同時間取上層清液滴加KSCN溶液。3min 時溶液呈淺紅色,30min后溶液幾乎無色。
)中加入過量鐵粉,攪拌后靜置,不同時間取上層清液滴加KSCN溶液。3min 時溶液呈淺紅色,30min后溶液幾乎無色。
②實驗II的現(xiàn)象說明發(fā)生了反應__________(用離子方程式表示)。
(5)實驗Ⅱ中發(fā)生的反應可以用下列裝置來驗證。其中甲溶液是___________,分別取電池工作前與工作一段時間后左側燒杯中溶液,同時滴加KSCN溶液,_______ (“前者”或“后者”)紅色更深。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一無色透明溶液,取出少量滴入BaCl2溶液,只有白色沉淀生成;另取一定體積的無色溶液加入過量Na2O,有白色沉淀生成,其沉淀量與加入Na2O的量的關系如圖所示。原無色透明溶液中一定存在的離子是
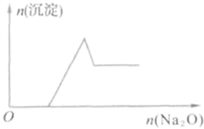
①H+ ②NH4+ ③Al3+ ④Mg2+ ⑤Fe2+ ⑥NO3- ⑦SO42-
A.③④B.③④⑦C.①③④⑦D.②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某離子晶體的晶胞示意圖如圖所示,其摩爾質量為Mg/mol,阿伏加德羅常數(shù)的值為NA,晶體的密度為dg/cm3下列說法中正確的是
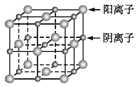
A.晶體晶胞中陰、陽離子的個數(shù)都為1
B.晶體中陰、陽離子的配位數(shù)都是4
C.該晶胞可能是NaCl的晶胞
D.該晶體中兩個距離最近的陽離子的核間距為4M/(NAd)cm
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com