
【題目】Ⅰ.(1)實驗室常用石灰石與鹽酸反應制取CO2,請寫出該反應的離子方程式__________。
(2)實驗室常用鋅粒與稀硫酸制取氫氣,請寫出該反應的離子方程式__________。
Ⅱ.(1)實驗室常將飽和三氯化鐵溶液滴入沸水中繼續加熱至紅褐色制備氫氧化鐵膠體,請寫出制備氫氧化鐵膠體的化學方程式___________。
(2)將Fe(OH)3 膠體裝入U形管內,用石墨做電極,接通直流電,通電一段時間后發現陰極附近的顏色逐漸加深,這表明Fe(OH)3膠體微粒帶 _________ (填“正”或“負”)電荷。
(3)取少量Fe(OH)3 膠體于試管中,逐滴加入硫酸至過量,可看到的現象是____________。
(4)3.4gOH-中有_________mol OH-,其含有的電子數是_______個(阿伏加德羅常數用NA表示)。在同溫同壓下CH4和N2組成的混合氣體對H2的相對密度為10,則混合氣體中CH4與N2的體積比為_____。
【答案】CaCO3+2H+=Ca2++CO2↑+H2O H++Zn=H2↑+Zn2+ FeCl3+3H2O![]() Fe(OH)3(膠體)+3HCl 正 先產生紅褐色沉淀,接著沉淀又消失生成棕黃色溶液 0.2 2NA 2:1
Fe(OH)3(膠體)+3HCl 正 先產生紅褐色沉淀,接著沉淀又消失生成棕黃色溶液 0.2 2NA 2:1
【解析】
Ⅰ.(1)碳酸鈣和鹽酸反應生成氯化鈣、水和二氧化碳,據此書寫;
(2)鋅與稀硫酸反應生成硫酸鋅和氫氣,據此書寫;
Ⅱ.(1)氯化鐵與沸水反應生成氫氧化鐵膠體,據此書寫;
(2)根據氫氧化鐵膠體能產生電泳現象分析判斷;
(3)根據膠體可以發生聚沉以及氫氧化鐵能與稀硫酸反應分析判斷;
(4)根據m=nM、阿伏加德羅定律以及物質的組成分析計算。
Ⅰ.(1)實驗室常用石灰石與鹽酸反應制取CO2,該反應的離子方程式為CaCO3+2H+=Ca2++CO2↑+H2O。
(2)實驗室常用鋅粒與稀硫酸制取氫氣,該反應的離子方程式為2H++Zn=H2↑+Zn2+。
Ⅱ.(1)實驗室常將飽和三氯化鐵溶液滴入沸水中繼續加熱至紅褐色制備氫氧化鐵膠體,制備氫氧化鐵膠體的化學方程式為FeCl3+3H2O![]() Fe(OH)3(膠體)+3HCl。
Fe(OH)3(膠體)+3HCl。
(2)將Fe(OH)3膠體裝入U形管內,用石墨做電極,接通直流電,通電一段時間后發現陰極附近的顏色逐漸加深,這說明氫氧化鐵的膠粒向陰極移動,則Fe(OH)3膠體微粒帶正電荷。
(3)取少量Fe(OH)3膠體于試管中,逐滴加入硫酸至過量,開始膠體發生聚沉產生氫氧化鐵沉淀,然后氫氧化鐵和稀硫酸發生中和反應生成硫酸鐵和水,所以可看到的現象是先產生紅褐色沉淀,接著沉淀又消失生成棕黃色溶液。
(4)3.4gOH-中含有OH-的物質的量是3.4g÷17g/mol=0.2mol,1個氫氧根離子含有10個電子,則其中含有的電子數是2NA個。在同溫同壓下CH4和N2組成的混合氣體對H2的相對密度為10,則根據阿伏加德羅定律可知混合氣體的平均相對分子質量是10×2=20,所以依據十字交叉法可知混合氣體中CH4與N2的體積比為(28-20)/(20-16)=2:1。


科目:高中化學 來源: 題型:
【題目】下列事實中能說明亞硝酸是弱電解質的是( )
A. 用![]() 溶液做導電試驗,燈光較暗
溶液做導電試驗,燈光較暗
B. ![]() 是共價化合物
是共價化合物
C. 亞硝酸不與氯化鈉反應
D. 常溫下0.1mol/L亞硝酸溶液的氫離子約為0.01mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將NO2裝入帶有活塞的密閉容器中,當反應2NO2(g)![]() N2O4(g)達到平衡后,改變下列一個條件,下列敘述正確的是
N2O4(g)達到平衡后,改變下列一個條件,下列敘述正確的是
A. 升高溫度,氣體顏色加深,則此反應為吸熱反應
B. 慢慢壓縮氣體體積,平衡向正反應方向移動,混合氣體的顏色變淺
C. 慢慢壓縮氣體體積,若體積減小一半,壓強增大,但小于原來的兩倍
D. 恒溫恒容時,充入稀有氣體,壓強增大,平衡向正反應方向移動,混合氣體的顏色變淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定質量的AlCl3和MgCl2混合溶液中逐漸滴入一定溶質質量分數的NaOH溶液,生成沉淀的物質的量與加入NaOH的物質的量的關系如圖所示,則:
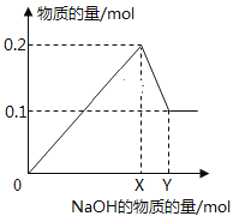
(1)O-X段反應的離子方程式為:________________________,
(2)X-Y段反應的離子方程式為_________________________
(3)生成Mg(OH)2的質量為___________________g;
(4)X=________________;Y=______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖裝置研究電化學原理,下列分析中錯誤的是
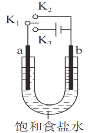
選項 | 連接 | 電極材料 | 分析 | |
a | b | |||
A | K1K2 | 石墨 | 鐵 | 模擬鐵的吸氧腐蝕 |
B | K1K2 | 鋅 | 鐵 | 模擬鋼鐵防護中犧牲陽極的陰極保護法 |
C | K1K3 | 石墨 | 鐵 | 模擬電解飽和食鹽水 |
D | K1K3 | 鐵 | 石墨 | 模擬鋼鐵防護中外加電流的陰極保護法 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入適量FeCl3溶液,不同時刻測得生成O2的體積(已折算為標準狀況)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
資料顯示,反應分兩步進行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反應過程中能量變化如右圖所示。下列說法不正確的是

A. 0~6 min的平均反應速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快過氧化氫的分解速率
C. 反應①是吸熱反應、反應②是放熱反應
D. 反應2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿性電池具有容量大、放電電流大的特點,因而得到廣泛應用.鋅﹣錳堿性電池以氫氧化鉀溶液為電解液,電池總反應式為:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列說法錯誤的是( )
Zn(OH)2(s)+Mn2O3(s) 下列說法錯誤的是( )
A. 電池工作時,鋅失去電子
B. 電池正極的電極反應式為:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 電池工作時,電子由正極通過外電路流向負極
D. 外電路中每通過0.2mol電子,鋅的質量理論上減小6.5g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在常溫下,Fe與水并不發生反應,但在高溫下,Fe與水蒸氣可發生反應。高溫下Fe與水蒸氣的反應實驗應使用如圖所示的裝置,在硬質玻璃管中放入鐵粉和石棉絨的混合物,通入水蒸氣并加熱。請回答實驗的相關問題。
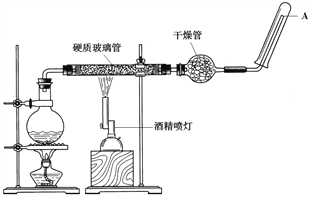
(1)該反應的反應方程式為_________。
(2)圓底燒瓶中裝的是水,該裝置的主要作用是______________;燒瓶底部放了幾片碎瓷片,碎瓷片的作用是________________________。
(3)干燥管中盛裝的物質是____________,作用是________________________。
(4)如果要在A處玻璃管口點燃該氣體,則必須對該氣體進行____________,方法是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com