
【題目】設NA為阿伏加德羅常數的值。下列有關敘述不正確的是
A.乙烯和環丁烷(C4H8)的混合氣體共28g含有的原子數目為6NA
B.0.1 mol羥基中所含有的電子數為NA
C.1 L0.1 mol·L-1 Na2S溶液中,S2-、 HS-和H2S的微粒數之和為0.1NA
D.在K37C1O3+6H35Cl(濃)=KCl+3Cl2↑+3H2O反應中,若反應中電子轉移的數目為10NA則有424g氯氣生成
【答案】B
【解析】
A.乙烯和環丁烷(C4H8)的最簡式為CH2,28g乙烯和環丁烷的混合氣體含3molCH2,故28g乙烯和環丁烷的混合氣體含有的原子數目為6NA,A正確;
B.1個羥基(![]() )中含有9個電子,故0.1 mol羥基中所含有的電子數為0.9NA,B錯誤;
)中含有9個電子,故0.1 mol羥基中所含有的電子數為0.9NA,B錯誤;
C.硫化鈉的物質的量為0.1mol,S元素在溶液中以S2-、HS-、H2S三種形式存在,由元素守恒可知S2-、 HS-和H2S的微粒數之和為0.1NA,C正確;
D.同種元素不同價態的原子之間若發生氧化還原反應元素的化合價只靠近不交叉,在K37C1O3+6H35Cl(濃)=KCl+3Cl2↑+3H2O反應中,氯酸鉀中的1個37C1轉化為氯氣分子中0價氯原子,H35Cl中有5個35Cl轉化為氯氣分子中0價氯原子,反應中轉移5mol電子生成3mol氯氣,且氯氣中的37C1:35Cl=1:5,故這樣的氯氣的相對分子質量為![]() ,若反應中電子轉移的數目為10NA,則生成6mol氯氣,其質量為
,若反應中電子轉移的數目為10NA,則生成6mol氯氣,其質量為
![]() = 424g,D正確;
= 424g,D正確;
答案選B。


 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:
【題目】最新報道:科學家首次用X射線激光技術觀察到CO與O在催化劑表面形成化學鍵的過程.反應過程的示意圖如下:
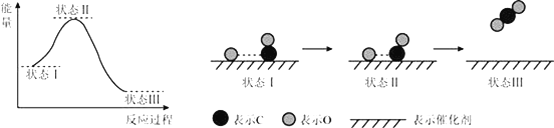
下列說法正確的是
A. CO和O生成CO2是吸熱反應
B. 在該過程中,CO斷鍵形成C和O
C. 同物質的量的CO和O反應比CO與O2反應放出更多熱量
D. 狀態Ⅰ→狀態Ⅲ表示CO與O2反應的過程
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究小組發現一種化合物在一定波長的光照射下發生分解反應,反應物濃度隨反應時間變化如下圖所示,計算反應4min~8min間的平均反應速率和推測反應16 min時反應物的濃度,結果應是
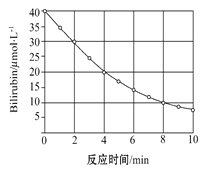
A. 2.5μmol·L-1·min-1和2.0μmol·L-1
B. 2.5μmol·L-1·min-1和2.5μmol·L-1
C. 3.0μmol·L-1·min-1和3.0μmol·L-1
D. 3.0μmol·L-1·min-1和2.5μmol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Y、Z、W、R、M五種元素,位于元素周期表的前四周期,它們的核電荷數依次增大,有如下信息:
元素 | 相關信息 |
Y | 原子核外有6個不同運動狀態的電子 |
Z | 非金屬元素,基態原子的s軌道的電子總數與p軌道的電子總數相同 |
W | 主族元素,與Z原子的價電子數相同 |
R | 價層電子排布式為3d64s2 |
M | 位于第ⅠB族,其被稱作“電器工業的主角” |
請回答下列問題(Y、Z、W、R、M用所對應的元素符號表示):
(1)Z、W元素相比,第一電離能較大的是____,M2+的核外電子排布式為_______。
(2)M2Z的熔點比M2W的______(填“高”或“低”),請解釋原因:_____________。
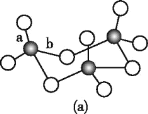
(3)WZ2的VSEPR模型名稱為______;WZ3氣態為單分子,該分子中W原子的雜化軌道類型為____;WZ3的三聚體環狀結構如圖(a)所示,該結構的分子中含有____個σ鍵;寫出一種與WZ3互為等電子體的分子的化學式_____。
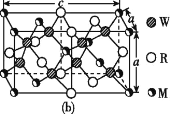
(4)MRW2的晶胞如圖(b)所示,晶胞參數a=0.524 nm、c=1.032 nm;MRW2的晶胞中,晶體密度ρ=____g/cm3(只要求列算式,不必計算出數值,阿伏加德羅常數為NA=6.02×1023 mol-1)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,該反應是一個可逆反應,若反應物起始的物質的量相同,下列關于該反應的示意圖不正確的是
A. 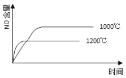
B. 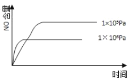
C. 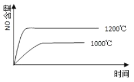
D. 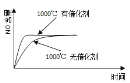
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵及其化合物在生產生活中有著廣泛的應用。回答下列問題:
(1)基態Fe原子的外圍電子排布圖為____,基態Fe2+中,核外電子占據最高能層的符號是____,Fe2+和Fe3+是鐵的兩種常見離子,Fe3+的穩定性強于Fe2+,原因是____。
(2)Fe3+可以與SCN—形成一系列不同配位數的紅色配合物,所以常用KSCN溶液檢驗Fe3+的存在,KSCN中四種元素的電負性由小到大的順序為_______,SCN—的幾何構型為______,中心原子的雜化類型為_______。
(3)實驗中常用K3[Fe(CN)6]檢驗Fe2+, K3[Fe(CN)6]晶體中的化學鍵有_________(填寫選項字母)
a.離子鍵. b.共價鍵 c,氫鍵 d .配位鍵 e.金屬鍵
1mol K3[Fe(CN)6]中含有σ鍵與π鍵的數目比為_____________。
(4)FexO為氯化鈉型結構,在實際晶體中,由于存在缺陷,x<1。 測得Fe0.92O晶體的晶胞參數a=428.0pm,則該晶體的密度ρ=__________g/cm3 (列出計算式),晶體中最近的兩個鐵離子間的距離為_______pm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種新型氟離子電池的電解質為![]() 和
和![]() ,
,![]() 可嵌入這兩種鹽的晶體中,該電池工作時放電的示意圖如圖所示,下列判斷正確的是( )
可嵌入這兩種鹽的晶體中,該電池工作時放電的示意圖如圖所示,下列判斷正確的是( )
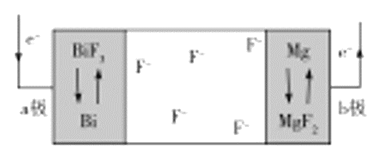
A.放電時,![]() 極為該電池的正極
極為該電池的正極
B.充電時,![]() 移向
移向![]() 極
極
C.充電時,陽極的電極反應式為![]()
D.電池總反應為![]()
![]()
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】粗硅中含有鐵和錫(Sn)等雜質,粗硅與氯氣反應可生成SiCl4,SiCl4經提純后用氫氣還原可得高純硅。實驗室用下列裝置模擬制備SiCl4。已知:SiCl4的熔點是-70℃,沸點是57.6℃,易與水反應;Sn Cl4的熔點是-33℃,沸點是114℃
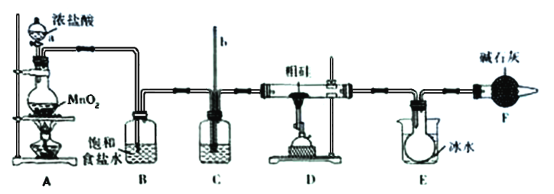
回答下列問題:
(1)儀器a的名稱是_______;裝置A燒瓶中發生反應的離子方程式是____________。
(2)裝置C中盛放的試劑是_____________,作用是___________________;玻璃管b的作用是_______________________。
(3)裝置E的燒杯中盛放冰水的目的是______________________。
(4)裝置F中堿石灰的作用是____________________________。
(5)裝置E燒瓶中得到的SiCl4中溶有少量的雜質FeCl3和SiCl4,可以通過___________方法提純。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com