
【題目】下列物質不能氧化乙醇的是( )
A. 氧氣 B. 氧化銅
C. 稀硫酸 D. 酸性高錳酸鉀溶液
 奪冠訓練單元期末沖刺100分系列答案
奪冠訓練單元期末沖刺100分系列答案 新思維小冠軍100分作業本系列答案
新思維小冠軍100分作業本系列答案 名師指導一卷通系列答案
名師指導一卷通系列答案科目:高中化學 來源: 題型:
【題目】(1)過渡金屬元素鐵能形成多種配合物,如:[Fe(H2NCONH2)6](NO3)3。[三硝酸六尿素合鐵(Ⅲ)]和Fe(CO)x等。
①基態Fe3+的M層電子排布式是________________。
②尿素(H2NCONH2)分子中C、N原子的雜化方式分別是__________、__________。
③配合物Fe(CO)x的中心原子價電子數與配體提供電子數之和為18,則x =_______。
(2)Zn2+能與NH3形成配離子[Zn(NH3)4]2+。配位體NH3的VSEPR模型名稱為_____;在[Zn(NH3)4]2+中,Zn2+位于正四面體中心,N位于正四面體的頂點,試在左下圖中表示出[Zn(NH3)4]2+中Zn2+與N之間的化學鍵_____。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. CH(CH2CH3)3的名稱是3-甲基戊烷
B. ![]() 和
和![]() 、
、![]() 和
和![]() 都屬于同一種物質
都屬于同一種物質
C. 乙醛和丙烯醛(![]() )不是同系物,與氫氣充分反應后產物也不是同系物
)不是同系物,與氫氣充分反應后產物也不是同系物
D. 向苯中加入酸性高錳酸鉀溶液震蕩后靜置,觀察到液體分層,且上、下層均無色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能將氯化鐵、氯化銨和氯化鈉三種溶液區別開的一種試劑是 ( )
A. KSCN溶液 B. BaCl2溶液
C. AgNO3溶液 D. NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,冰醋酸在加水稀釋過程中溶液導電能力的變化曲線如圖所示,請回答下列問題:

(1)O點導電能力為零的原因是_______________________________。
(2)a、b、c三點中,CH3COOH的電離度最大的是________;a、b、c三點的pH由小到大的順序是___________CH3COOH的電離平衡常數表達式Ka=________。
(3)若使c點溶液中c(CH3COO-)增大,則下列措施中,可選擇________(填字母序號)。
A.加熱 B.加入很稀的NaOH溶液
C.加入固體KOH D.加水
E.加入固體CH3COONa F.加入鋅粒
(4)在CH3COOH溶液的稀釋過程中,始終保持增大趨勢的是________(填字母序號)。
A.c(H+) B.H+的個數
C.CH3COOH的分子數 D.c(H+)/c(CH3COOH)
(5)下列有關CH3COOH溶液的說法正確的是________(填字母序號)。
A.CH3COOH溶液中各離子濃度的關系為c(H+)=c(OH-)+c(CH3COO-)
B.向0.10 mol/L的CH3COOH溶液中加水,c(H+)增大
C.CH3COOH溶液中各離子濃度的關系為c(CH3COO-)>c(H+)>c(OH-)
D.常溫下,c(H+)=0.01 mol/L的CH3COOH溶液與c(OH-)=0.01 mol/L的NaOH溶液等體積混合后,溶液呈堿性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組同學為了探究“在相同的溫度和壓強下、相同體積的任何氣體都含有相同數目和分子”,他們設計了如下實驗裝置并記錄相關實驗數據。
實驗裝置:
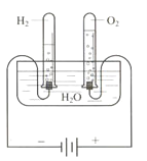
部分實驗數據:
溫度 | 壓強 | 時間 | 水槽中H2O的質量 | H2體積 | O2體積 |
30℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30℃ | 101 kPa | 4分鐘 | 298.2 g | 1.243 L |
請回答下列問題:
(1)4分鐘時H2、O2物質的量分別是 mol、 mol。
(2)該溫度下,氣體摩爾體積是 。
(3)假設電解H2O速率相同,2分鐘時試管內收集到的H2的體積是 mL。
(4)根據以上實驗得出如下結論,其中不正確的是 。
A. 氣體摩爾體積與氣體的溫度相關
B. 在該實驗條件下,3 mol O2的氣體摩爾體積為74.58 L/mol
C. 同溫、同壓下,2 mol O2和2 mol CO和CO2混合氣體的體積相同
D. 該實驗條件下,O2的密度為1.287 g/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】霧霾天氣嚴重影響人們的生活,其中氮氧化物和硫氧化物都是形成霧霾天氣的重要因素。下列方法可處理氮氧化物和硫氧化物。
(1) 用活性炭還原法可以處理氮氧化物。某研究小組向某密閉容器中加入一定量的活性炭和NO,在一定條件下,發生反應:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ/mol。
N2(g)+CO2(g) ΔH=Q kJ/mol。
在T1℃時,反應進行到不同時間測得各物質的濃度如下表。
時間/min 濃度/mol/L | 0 | 10 | 20 | 30 |
NO | 1.00 | 0.58 | 0.40 | 0.40 |
N2 | 0 | 0.21 | 0.30 | 0.30 |
CO2 | 0 | 0.21 | 0.30 | 0.30 |
①0~10 min內,NO的平均反應速率v(NO)=_____________,T1℃時,該反應的平衡常數K= _____________。
②若30 min后升高溫度至T2℃,達到平衡時,容器中NO、N2、CO2的濃度之比為2∶1∶1,則Q_____________ (填“>”、“=”或“<”) 0。
(2) NH3催化還原氮氧化物(SCR)技術是目前應用最廣泛的煙氣氮氧化物脫除技術。反應原理如圖甲所示。

①由圖甲可知,SCR技術中的氧化劑為_____________。已知 NH3氧化時發生如下反應:
4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH2=-1811.63kJ·mol-1
則氨氣被氧化為氮氣和水蒸氣的熱化學方程式:_______________________
②圖乙是不同催化劑Mn和Cr在不同溫度下對應的脫氮率,由圖可知工業選取的最佳催化劑及相應的溫度分別為___________、___________。
(3) 煙氣中的SO2可用某濃度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,若所得溶液呈中性,則該溶液中c(Na+)=__________________(用含硫微粒濃度的代數式表示)。
(4) 某研究小組用NaOH溶液吸收二氧化硫后,將得到的Na2SO3溶液進行電解,其中陰陽膜組合電解裝置如圖丙所示,電極材料為石墨。

丙
①a表示_______(填“陰”或“陽”)膜。A-E分別代表原料或產品,其中C為稀硫酸,則A為____________溶液(填寫化學式)。
②陽極電極反應式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.實驗是化學研究的一種重要手段,現有下圖所示A~G七種儀器,請根據要求填空。

(1)寫出儀器名稱:E_____________,F_____________。
(2)下列實驗操作中用到儀器D的是_________(選填下列選項的編號字母 )。
A.分離水和CCl4的混合物 B.分離水和酒精的混合物 C.分離水和泥砂的混合物
Ⅱ.某課外興趣小組需要200 mL1 mol/L的Na2CO3溶液,請回答下列問題:
(1)配制溶液所需儀器及藥品:
應稱取Na2CO3的質量 ______(g) | 應選用容量瓶的規格 _______(mL) | 除容量瓶外還需要的其它玻璃儀器是上圖中的______、_____及玻璃棒 |
(2)配制時,其正確的操作順序是(用字母表示,每個操作只能用一次)______________。
A.將已冷卻的溶液沿玻璃棒注入容量瓶中
B.用托盤天平準確稱量所需Na2CO3的質量,倒入燒杯中,再加入適量水,用玻璃棒慢慢攪動,使其溶解(必要時可加熱)
C.用適量水洗滌燒杯2~3次,洗滌液均注入容量瓶中,振蕩
D.改用膠頭滴管加水,使溶液凹液面恰好與刻度線相切
E.將容量瓶蓋緊,振蕩,搖勻
F.繼續往容量瓶內小心加水,直到液面接近刻度1~2 cm處
(3)若出現如下情況,對所配溶液濃度將有何影響 (填“偏高”、“偏低”或“無影響”)?
沒有進行C操作________;配制溶液時,容量瓶未干燥_________;定容時俯視刻度線_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com