
【題目】以下是有關SO2、Cl2的性質實驗。
某小組設計如圖所示的裝置圖(圖中夾持和加熱裝置略去),分別研究SO2和Cl2的性質。
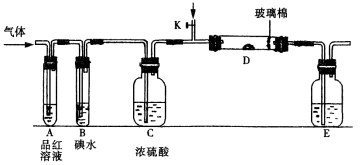
①若從左端分別通入SO2和Cl2,裝置A中觀察到的現象是否相同? (填“相同”或“不相同”);若D中盛銅粉,通入足量的Cl2,D中的現象是___________;若裝置D中裝的是五氧化二釩(催化劑),通入SO2時,打開K通入適量O2的化學反應方程式為 。
②SO2通入B中,碘水褪色,則該反應的離子方程式為 。
③E中盛有______________溶液。
某同學將足量的SO2通入一支裝有氯化鋇溶液的試管,未見沉淀生成,若向該試管中加入足量(填字母) ,則可以看到白色沉淀產生。
A.氨水 B.硝酸鈉溶液 C.氯化鈣溶液
若由元素S和O組成–2價酸根離子X,X中S和O的質量比為4∶3;當Cl2與含X的溶液完全反應后,得澄清溶液,取少量該溶液加入鹽酸酸化的氯化鋇溶液,有白色沉淀產生。寫出Cl2與含X的溶液反應的離子方程式 。
【答案】
(1)①相同;Cu粉紅熱,并產生棕黃色煙;2SO2 + O2![]() 2SO3;
2SO3;
②SO2 + I2 + 2H2O = 4H++ 2I-+ SO42-;③NaOH;
(2)A B;(3)4Cl2 + S2O32-+ 5H2O = 2SO42-+ 8Cl-+ 10H+;
【解析】
試題分析:(1)①二氧化硫能和有色物質反應生成無色物質,所以二氧化硫有漂白性;氯氣和水反應生成次氯酸,次氯酸具有強氧化性,能使有色物質褪色,所以若從左端分別通入SO2和Cl2,裝置A中觀察到的現象相同,都使品紅褪色;銅粉在Cl2中加熱Cu粉紅熱,并生成產生棕黃色煙氯化銅;二氧化硫和氧氣在五氧化二釩作催化劑、加熱條件下能發生氧化還原反應生成三氧化硫,反應方程式為 2SO2+O2 ![]() 2SO3,故答案為:相同;Cu粉紅熱,并產生棕黃色煙;2SO2+O2
2SO3,故答案為:相同;Cu粉紅熱,并產生棕黃色煙;2SO2+O2 ![]() 2SO3;
2SO3;
②SO2通入B裝置碘水中,溶液顏色退去,發生了氧化還原反應:碘單質具有氧化性,二氧化硫具有還原性,被碘單質氧化為硫酸,本身被還原為碘化氫,反應的離子方程式為:SO2+I2+2H2O=4H++2I-+SO42-,故答案為:SO2+I2+2H2O=4H++2I-+SO42-;
③E為尾氣處理,吸收多余的SO2和Cl2應盛有氫氧化鈉溶液,故答案為:NaOH;
(2)將足量的SO2通入一支裝有氯化鋇溶液的試管,未見沉淀生成,若向該試管中加入足量試劑仍然無法觀察到沉淀產生,說明不發生反應:A、氨水加入后生成亞硫酸銨,亞硫酸根和鋇離子生成沉淀,故A正確;B、硝酸鈉溶液中含有硝酸根離子,通入二氧化硫后,溶液顯酸性,將二氧化硫氧化成硫酸根,與鋇離子生成硫酸鋇沉淀,故B正確;C.氯化鈣溶液和二氧化硫不反應,故C錯誤;故答案為:AB
(3)若由元素S和O組成-2價酸根離子X,X中S和O的質量比為4:3,所以X中S和O的原子個數比為![]() :
:![]() =3:2,所以該離子為S2O3 2-;氯氣有強氧化性,能和硫代硫酸根離子發生氧化還原反應,根據題意知,該反應中有硫酸根離子生成,所以氯氣中氯元素得電子生成氯離子,所以該反應的離子方程式為Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+,故答案為:4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+。
=3:2,所以該離子為S2O3 2-;氯氣有強氧化性,能和硫代硫酸根離子發生氧化還原反應,根據題意知,該反應中有硫酸根離子生成,所以氯氣中氯元素得電子生成氯離子,所以該反應的離子方程式為Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+,故答案為:4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】一種氣態烷烴和一種氣態烯烴,它們分子里的碳原子數相等.將1.0體積這種混合氣體在氧氣中完全燃燒,生成2.0體積的CO2和2.4體積的水蒸氣(氣體體積均在相同狀況下測定),則混合氣體中烷烴和烯烴的體積比為( )
A.3:1 B.1:3 C.2:3 D.3:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯酚和丙酮都是重要的化工原料,工業上可用異丙苯氧化法生產苯酚和丙酮,其反應和工藝流程示意圖如下:
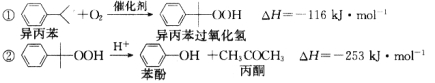
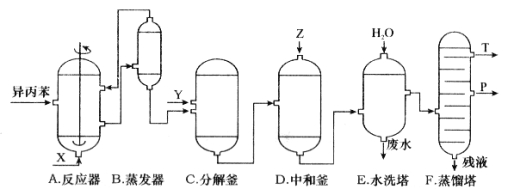
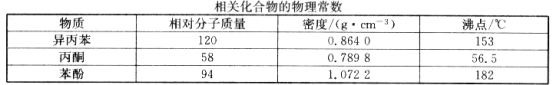
回答下列問題:
(1)在反應器 A 中通入的 X 是 。
(2)反應①和②分別在裝置 和 中進行。(填裝置符號)
(3)在分解釜 C中加入的Y為少量濃硫酸,其作用是 ,優點是用量少,缺點是 。
(4)反應②為 (填“放熱”或“吸熱”)反應。反應溫度應控制在 50~60℃,溫度過高的安全隱患是 。
(5)中和釜 D 中加入的 Z 最適宜的是 (填序號。已知苯酚是一種弱酸)。
A.NaOH B.CaCO3 C.NaHCO3 D.CaO
(6)蒸餾塔 F 中的餾出物 T 和 P 分別為 和 ,判斷的依據是 。
(7)用該方法合成苯酚和丙酮的優點是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ag/A12O3催化劑在工業上具有廣泛用途。廢銀催化劑中銀的回收既可節約資源,又有較好的經濟效益。回收銀的簡化流程如下圖所示(部分條件和試劑略):

請回答下列問題:
(1)第I步中,載體A12O3不與稀硝酸反應。Ag和稀硝酸反應產生的氣體是____________。
(2)第II步中,飽和食鹽水由工業食鹽水提純而得。除去工業食鹽水中的少量Na2SO4、MgC12、CaC12雜質,正確的操作順序是_________(填字母編號)。
a.加入稍過量的NaOH溶液
b.加入稍過量的BaC12溶液
c.過濾
d.加入稍過量的Na2CO3溶液
e.加入適量鹽酸
(3)第III步中,加入氨水使沉淀溶解的離子方程式是____________ 。
(4)N2H4具有還原性,氧化產物為N2。第IV步反應的產物除Ag和N2外,還有的物質是_______(填化學式)。
(5)N2H4可用作火箭推進劑。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H = -534 kJ/mol
2NO(g)+O2(g)=2NO2(g) △H = -116 kJ/mol
N2(g)+O2(g)=2NO(g) △H = +183 kJ/mol
N2H4和NO2反應生成N2和氣態H2O的熱化學方程式是______________________。
(6)Ag可制備銀鋅紐扣電池正極材料Ag2O,堿性條件下該電池的正極反應式是____。
(7)若上述流程中第I、II、III步銀的回收率均為90%,則處理以a kg含銀b%的廢銀催化劑,理論上需要加入N2H4的質量是________kg。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠的廢金屬屑的主要成分為鋁、鐵和銅,某化學興趣小組在學習了元素及其化合物的相關知識后,設計了如圖1實驗流程,用該工廠的金屬廢料制取氯化鋁、綠礬晶體(FeSO4·7H2O)和膽礬晶體(CuSO4·5H2O)。


請回答:
(1)鋁在周期表中位于 周期 族。
(2)步驟Ⅰ進行的實驗操作的名稱是 。
(3)寫出步驟Ⅱ反應中生成C的離子方程式: 。
(4)進行步驟Ⅱ時,該小組 用如圖2所示裝置及試劑制取CO2并將制得的氣體通入溶液A中一段時間后,觀察到燒杯中產生的白色沉淀會逐漸減少,原因是 。
(5)用固體F制備CuSO4溶液,可設計如圖3三種途徑:
寫出途徑③中反應的化學方程式: ,用途徑①制備CuSO4溶液時,混酸中硫酸和硝酸的最佳物質的量之比為 。
(6)用途徑②制備CuSO4溶液與途徑①、③相比優點是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣燃燒生成液態水的熱化學方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。請回答下列問題:
(1)生成物能量總和________(填“大于”“小于”或“等于”)反應物能量總和。
(2)若2 mol氫氣燃燒生成水蒸氣,則放出的熱量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的標準燃燒熱ΔH=________。
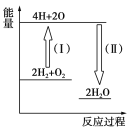
(4)反應2H2+O2![]() 2H2O的能量變化如圖所示。
2H2O的能量變化如圖所示。
已知拆開1 mol H2、1 molO2和1 mol H—O中的化學鍵分別需要消耗436 kJ、496 kJ和463 kJ的能量。
則反應過程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)實驗室需要450 mL 0.02 mol/L酸性KMnO4標準溶液,現有儀器:
① 托盤天平 ② 玻璃棒 ③ 藥匙 ④ 200mL燒杯 ⑤ 量筒,還需要 玻璃儀器才能完成配制,需稱量KMnO4固體 g。
(2)下列操作會使配制的KMnO4溶液濃度偏大的是 (填寫編號,假設其他操作均正確)。
A.沒有冷卻至室溫就轉移液體到容量瓶并完成定容 |
B.使用容量瓶配制溶液,定容時,俯視刻度線 |
C.沒有用蒸餾水洗滌燒杯2-3次,并將溶液移入容量瓶中 |
D.容量瓶剛用蒸餾水洗凈,沒有烘干就用來配制溶液 |
E.定容時,滴加蒸餾水,不慎液面略高于刻度線,吸出少量水使凹液面最低點與刻度線相切
(3)配平下面的方程式(將有關的化學計量數填入答題卡的橫線上):
□KMnO4+□H2C2O4+□H2SO4——□MnSO4+□K2SO4+□H2O+□CO2↑
(4)人體血液里Ca2+的濃度一般以mg/cm3為單位。為測定血液樣品中Ca2+的濃度,抽取血樣20.00 mL,加適量的草酸銨[(NH4)2C2O4]溶液,可析出草酸鈣(CaC2O4)沉淀,將沉淀洗滌后溶于強酸可得草酸(H2C2O4),再用上述標準0.02 mol/L 酸性KMnO4溶液滴定,使草酸轉化成CO2逸出,這時共消耗13.00 mL酸性 KMnO4溶液,請計算血液樣品中Ca2+的濃度為_________mg/cm3(保留到小數點后兩位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在2L密閉容器中投入一定量的A、B發生反應:3A(g) + bB (g) ![]() cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 時達到平衡,生成C的物質的量為0.8mol,反應過程如右圖所示。下列說法正確的是
cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 時達到平衡,生成C的物質的量為0.8mol,反應過程如右圖所示。下列說法正確的是

A.前12s內,A的平均反應速率為0.025mol·L-1·s-1
B.12s后,A的消耗速率等于B的生成速率
C.化學計量數之比b :c=1 :2
D.12s內,A和B反應放出的熱量為0.2Q kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)有兩種氣態烷烴的混合物,在標準狀況下密度為1.16gL﹣1,則下列關于此混合物組成中一定含有的烴是的化學式是 .該烴和氯氣在光照下反應生成的有機物共有 種,其中 (填寫化學式)在常溫下呈氣態.
(2)燃燒法是測定有機化合物分子式的一種重要方法.完全燃燒0.1mol某烴后,將生成的氣體先通過足量的濃硫酸,濃硫酸增重9.0g,再將剩余氣體通過澄清石灰水,生成沉淀40g.據此求烴的分子式,并寫出該烴可能的結構簡式.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com