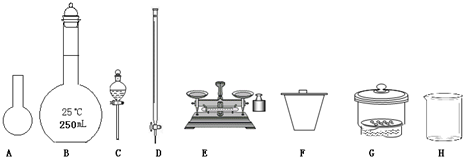
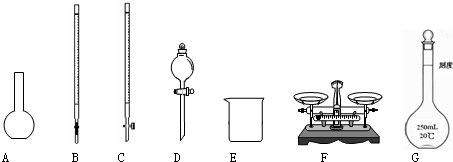
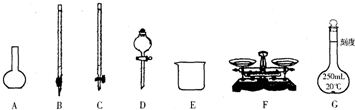
某化學興趣小組測定某FeCl
3樣品(只含少量FeCl
2雜質)中鐵元素的質量分數,按以下實驗步驟進行操作:
①稱取a g樣品,置于燒杯中;
②加入適量鹽酸和蒸餾水,使樣品溶解,然后準確配制成250.00mL溶液;
③量取25.00mL步驟②中配得的溶液,置于燒杯中,加入適量的氯水,使反應完全;
④加入過量氨水,充分攪拌,使沉淀完全;
⑤過濾,洗滌沉淀;
⑥將沉淀轉移到某容器內,加熱、攪拌,直到固體由紅褐色全部變為紅棕色后,在干燥器中冷卻至室溫后,稱量;
⑦….
請根據上面敘述,回答:
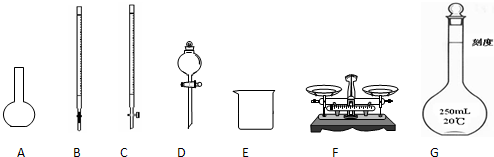
(1)圖所示儀器中,本實驗步驟①②③中必須用到的儀器是E和
CFG
CFG
(填字母).
(2)步驟②中加入鹽酸的作用
增強溶液酸性,抑止Fe2+Fe3+水解;
增強溶液酸性,抑止Fe2+Fe3+水解;
.
(3)寫出步驟④中發生反應的離子方程式
Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+
.
(4)樣品中的雜質Fe
2+有較強的還原性,完成并配平下列反應的離子方程式
6
6
Fe
2++
1
1
ClO
3-+
6
6
═
6
6
Fe
3++
1
1
Cl
-+
3
3
H
2O
從理論上分析,上述實驗中若將氯水改為NaClO
3時,對實驗結果造成
無影響
無影響
(填偏大、偏小或不影響),等物質的量的NaClO
3與Cl
2的氧化效率之比為
3:1
3:1
(5)第⑥步的操作中,將沉淀物轉移到
坩堝
坩堝
(填儀器名稱)中加熱,冷卻至室溫,稱量其質量為m
1g,再次加熱并冷卻至室溫稱量其質量為m
2g,若m
1與m
2差值較大,接下來的操作應當是
繼續加熱一段時間后,把坩堝放置于干燥器中冷卻,再稱量,至最后兩次稱得的質量差不超過0.1g為止
繼續加熱一段時間后,把坩堝放置于干燥器中冷卻,再稱量,至最后兩次稱得的質量差不超過0.1g為止
.
(6)本實驗需要稱量的最少次數是
5
5
次,若容器質量是W
1g,最終容器和固體的總質量是W
2g,則樣品中鐵元素的質量分數為
.(列出算式,不需化簡)
(7)已知Cl
2與熱的NaOH溶液可發生如下反應:
3Cl
2+6NaOH
5NaCl+NaClO
3+3H
2O
則Fe
3+、KClO
3、Cl
2三種物質其氧化性由強到弱的順序是
KClO3>Cl2>Fe3+
KClO3>Cl2>Fe3+
.