
【題目】【化學—選修5:有機化學基礎】
有機化合物X、Y、A、B、C、D、E、F、G之間的轉化關系如下圖。
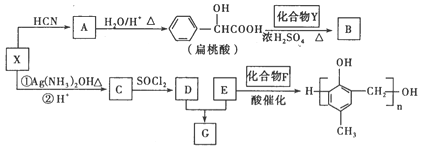
已知以下信息:
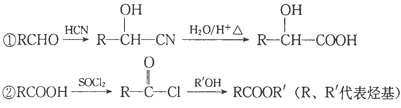
③X在催化劑作用下可與H2反應生成化合物Y。
④化合物F的核磁共振氫譜圖中只有一個吸收峰。
回答下列問題:
(1)X的含氧官能團的名稱是________,X與HCN反應生成A的反應類型是_________。
(2)酯類化合物B的分子式是C15H14O3,其結構簡式是_____________。
(3)X發生銀鏡反應的化學方程式是______________________。
(4)G在NaOH溶液中發生水解反應的化學方程式是__________________。
(5)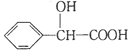 的同分異構體中:①能發生水解反應;②能發生銀鏡反應;
的同分異構體中:①能發生水解反應;②能發生銀鏡反應;
③能與氯化鐵溶液發生顯色反應;④含氧官能團處在對位。滿足上述條件的同分異構體共有________種(不考慮立體異構),寫出核磁共振氫譜圖中有五個吸收峰的同分異構體的結構簡式__________________。
(6)寫出以C2H5OH為原料合成乳酸(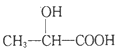 )的路線(其它試劑任選)。(合成路線常用的表示方式為:A
)的路線(其它試劑任選)。(合成路線常用的表示方式為:A![]() B……
B……![]() 目標產物)
目標產物)
【答案】(1)醛基;加成反應;(2)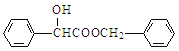 ;
;
(3)![]() ;
;
(4)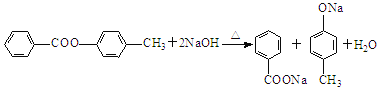 ;
;
(5)3,![]() ;
;
(6)![]() 。
。
【解析】
試題分析:根據流程轉化提示,可推斷出X為苯甲醛,X在催化劑作用下可與H2反應生成化合物Y,Y為苯甲醇,B為酯,C為苯甲酸,F的核磁共振氫譜圖中只有一個吸收峰,推斷出F為HCHO;E為對甲基苯酚;
(1)X的含氧官能團為醛基,根據提示①可知,該反應為加成反應;
(2)酯類化合物B的分子式是C15H14O3,根據推斷結果已知Y為苯甲醇,故B的結構簡式是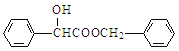 。
。
(3)X為苯甲醛,與銀氨溶液反應生成苯甲酸銨方程式為:![]() ;
;
(4)由于在NaOH存在的條件下,生成羧酸鈉和對甲基苯酚鈉,方程式為:
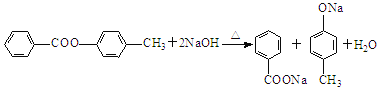 。
。
(5)根據提示可知,①能發生水解反應;說明含有酯基;②能發生銀鏡反應;說明該化合物中含有醛基;③能與氯化鐵溶液發生顯色反應;說明含有酚羥基;④含氧官能團處在對位。故其同分異構體可以有3種,同時滿足以上條件,可以是甲酸某酯,故結構簡式為:![]() ;
;
(6)結合已知信息可用采用逆推法分析合成路線,因此以乙醇為原料的合成路線圖為![]() 。
。


科目:高中化學 來源: 題型:
【題目】2015年5月郴州成功舉辦了第三屆中國(湖南)國際礦物寶石博覽會。礦博會上展示了色彩繽紛、形狀各異的金屬礦物,下列金屬的冶煉屬于熱還原法的是
A.2NaCl(熔融)= 2Na+Cl2↑
B.WO3+3H2 ![]() W+3H2O
W+3H2O
C.Fe+CuSO4 = Cu+FeSO4
D.2Ag2O ![]() 4Ag+O2↑
4Ag+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:碘單質能與I-反應成I3-,并在溶液中建立如下平衡:I2+I![]() I3-。通過測平衡體系中c(I2)、c(I-)和c(I3-),就可求得該反應的平衡常數。某同學為測定上述平衡體系中C(I2),采用如下方法:取V1mL平衡混合溶液,用cmolL-1的Na2S2O3溶液進行滴定(反應為I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2mL的Na2S2O3溶液。根據V1、V2和c可求得c(I2)。下列對該同學設計方案的分析,正確的是
I3-。通過測平衡體系中c(I2)、c(I-)和c(I3-),就可求得該反應的平衡常數。某同學為測定上述平衡體系中C(I2),采用如下方法:取V1mL平衡混合溶液,用cmolL-1的Na2S2O3溶液進行滴定(反應為I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2mL的Na2S2O3溶液。根據V1、V2和c可求得c(I2)。下列對該同學設計方案的分析,正確的是
A.方案可行,能準確測定溶液中的c(I2)
B.方案可行,可采用淀粉做該滴定反應的指示劑
C.不可行,只能測得溶液中c(I2)與c(I3-)之和
D.不可行,因為I-能與Na2S2O3溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是研究二氧化硫性質的微型實驗裝置。現用60%硫酸溶液和亞硫酸鈉晶體反應制取SO2氣體,實驗現象很明顯,且不易污染空氣。下列說法中錯誤的是( )
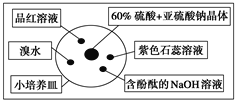
A. 紫色石蕊溶液變紅色,說明SO2呈酸性
B. 品紅溶液褪色,說明SO2具有漂白性
C. 溴水橙色褪去,體現了SO2的還原性
D. 含酚酞的NaOH溶液紅色變淺,表明SO2能夠和NaOH反應
查看答案和解析>>
科目:高中化學 來源: 題型:
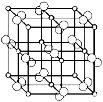
【題目】[化學—選修3:物質結構與性質]四川含有豐富的礦產資源,釩礦、鈦礦、黃鐵礦等七種礦產儲量位居全國第1位。回答下列問題:
(1)V2O5常用作SO2 轉化為SO3的催化劑。SO2 分子中鍵角 120°(填“>”、“<”或“=”);SO3分子中S原子的雜化軌道類型為 ;V2O5 溶解在NaOH溶液中,可得到釩酸鈉(Na3VO4),該鹽陰離子的立體構型為 。
(2)VO2+在酸性條件下可被草酸(H2C2O4)還原為VO2+,草酸被氧化為CO2,該反應用于釩含量的測定。寫出反應的離子方程式 。
(3)鈦在元素周期表中的位置為 ,其電子排布式為 。用乙醚從TiCl3的飽和溶液中萃取可得TiCl3·6H2O綠色晶體,其配位數為6,將1mol該晶體加入到足量硝酸銀溶液中可得2mol白色沉淀,則該配合物的化學式是 。
(4)科學家通過X射線探明,黃鐵礦(FeS2)的晶體結構與NaCl的晶體結構相似,若在FeS2晶體中陰陽離子間最近距離為a cm,阿伏伽德羅常數為NA。則晶體密度表達式為 g/cm3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學利用下圖所示實驗裝置進行某些氣體的制備、性質等試驗(圖中夾持裝置有省略)。請按要求填空:
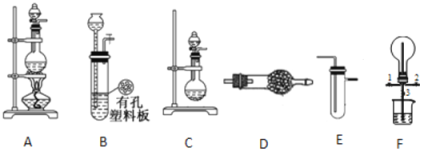
I.探究氯氣與氨氣的反應
(1)為制取干燥氨氣,可將裝置C與 (填裝置編號)連接;裝置C中的燒瓶內固體宜選用 。
a.堿石灰 b.氯化鈣 c.五氧化二磷 d.生石灰
(2)裝置A、E、E連接可制取純凈、干燥的氯氣,則兩個E裝置內的藥品依次是 。
(3)裝置F可用于探究氯氣與氨氣(已知氯氣與 氨氣可發生反應:3Cl2+2NH3=N2+6HCl)的反應。實驗時打開開關1、3,關閉2,先向燒瓶中通入 ,然后關閉1、3,打開2,向燒瓶中緩慢通入一定量的另一種氣體。實驗一段時間后燒瓶內出現濃厚的白煙并在容器內壁凝結,請設計一個實驗方案鑒定該固體中的陽離子 。
Ⅱ.探究某些物質的性質
(4)利用裝置A、E,可設計實驗比較Cl-和Br-的還原性強弱,能證明結論的實驗現象是 。
(5)若利用裝置A、E進行乙烯與溴水反應的實驗,寫出反應的化學方程式 。
(6)將裝置B、C分別與F相連后,進行H2S與SO2反應的實驗。F的燒瓶中發生反應的化學方程式為 ;F的燒杯所起的作用是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 堿性氧化物一定是金屬氧化物
B. 質子數、中子數和電子數都相同的粒子一定是同一種粒子
C. 任何元素在自然界中的存在形式都有化合態和游離態
D. 酸性氧化物一定是非金屬氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2氣體是一種常用的消毒劑,我國從2 000年起逐步用ClO2代替氯氣對飲用水進行消毒。
(1)消毒水時,ClO2還可將水中的Fe2+、Mn2+等轉化成Fe(OH)3和MnO2等難溶物除去,在這個過程中,Fe2+、Mn2+的化合價升高,說明ClO2具有__________性。
(2)工業上可以通過下列方法制取ClO2,請完成該化學反應方程式:2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通過灼熱的炭層,生成HCl和CO2,是放熱反應,當1molCl2參與反應時釋放145kJ的熱量,寫出這個反應的熱化學方程式:___________________。
(4)自來水廠用ClO2處理后的水中,要求ClO2的濃度在0.1~0.8mg·L-1之間。碘量法可以檢測水中ClO2的濃度,步驟如下:
Ⅰ.取一定體積的水樣,加入一定量的碘化鉀,再用氫氧化鈉溶液調至中性,并加入淀粉溶液,溶液變藍。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
Ⅲ.加硫酸調節水樣pH至1~3。
操作時,不同pH環境中粒子種類如下圖所示:
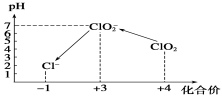
請回答:
①操作Ⅰ中反應的離子方程式是______________________。
②確定操作Ⅱ完全反應的現象是___________________。
③在操作Ⅲ過程中,溶液又呈藍色,反應的離子方程式是____________________。
④若水樣的體積為1.0 L,在操作Ⅱ時消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,則水樣中ClO2的濃度是________mg·L-1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com