
氧化還原反應綜合應用:氧化還原反應滴定
(1)配平氧化還原反應方程式:
C2O42-+ MnO4-+ H+= CO2↑+ Mn2++ H2O
(2)稱取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的試樣,加水溶解,配成250 mL溶液。量取兩份此溶液各25 mL,分別置于兩個錐形瓶中。
①第一份溶液中加入酚酞試液,滴加0.25 mol·L-1 NaOH溶液至20 mL時,溶液由無色變為淺紅色。該溶液被中和的H+的總物質的量為 mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高錳酸鉀溶液。
A.KMnO4溶液在滴定過程中作 (填“氧化劑”或“還原劑”),該滴定過程 (填“需要”或“不需要”)另加指示劑。滴至16 mL時反應完全,此時溶液顏色由 變為 。
B.若在接近終點時,用少量蒸餾水將錐形瓶沖洗一下,再繼續滴定至終點,則所測結果 (填“偏大”、“偏小”或“無影響”)。
C.若在達到滴定終點時俯視讀數,則所得結果 (填“偏大”、“偏小”或“無影響”)。
③原試樣中H2C2O4·2H2O的質量分數為 ,KHC2O4的質量分數為 。
 捷徑訓練檢測卷系列答案
捷徑訓練檢測卷系列答案 小夫子全能檢測系列答案
小夫子全能檢測系列答案科目:高中化學 來源: 題型:單選題
Cu2S與一定濃度的HNO3反應,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,當NO2和NO的物質的量之比為2:1時,實際參加反應的Cu2S與HNO3的物質的量之比為
| A.1:10 | B.1:8 | C.1:6 | D.1:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
銅單質及其化合物是應用極其廣泛的物質。
(1)銅是氫后金屬,不能與鹽酸發生置換反應,但將單質銅置于濃氫碘酸中,會有可燃性氣體及白色沉淀生成,又知氧化性:Cu2+>I2,則銅與氫碘酸反應的化學方程式為__________________________________
(2)已知Cu2O能溶于醋酸溶液或鹽酸中,同時得到藍色溶液和紅色固體,則Cu2O與稀硫酸反應的離子方程式為____________________________________;
Cu2O與稀硝酸反應的離子方程式為_____________________________;
只用稀硫酸來確定某紅色固體是 Cu2O與Cu組成的混合物的方法:稱取m g該紅色固體置于足量稀硫酸中,充分反應后過濾,然后___________________。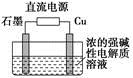
(3)Cu2O是一種半導體材料,基于綠色化學理念設計的制取Cu2O的電解裝置如圖所示,電解總反應:2Cu+H2O Cu2O+H2↑,則石墨應與電源的________極相連,銅電極上的電極反應式為________;電解過程中,陰極區周圍溶液pH________(填“變大”、“變小”或“不變”)。
Cu2O+H2↑,則石墨應與電源的________極相連,銅電極上的電極反應式為________;電解過程中,陰極區周圍溶液pH________(填“變大”、“變小”或“不變”)。
(4)現向Cu、Cu2O、CuO組成的混合物中加入1 L 0.6 mol/L HNO3恰好使混合物溶解,同時收集到2 240 mL NO(標準狀況)。若將上述混合物用足量的氫氣還原,所得固體的質量為________;若混合物中含有0.1 mol Cu,將該混合物與稀硫酸充分反應,至少消耗硫酸的物質的量為________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
向FeI2溶液中不斷通入Cl2,溶液中I-、I2、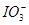 、Fe2+、Fe3+等粒子的物質的量隨n(Cl2)∶n(FeI2)變化的曲線如圖所示。
、Fe2+、Fe3+等粒子的物質的量隨n(Cl2)∶n(FeI2)變化的曲線如圖所示。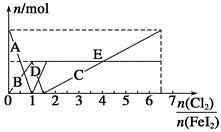
已知:2Fe3++2I-=I2+2Fe2+。
請回答下列問題:
(1)指出圖中折線E和線段C所表示的意義:折線E表示 ;線段C表示 。
(2)寫出線段D所表示的反應的離子方程式: 。
(3)當n(Cl2)∶n(FeI2)=6.5時,溶液中n(Cl-)∶n(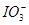 )= 。
)= 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
L、M、R、P、Q分別代表五種含不同化合價的氮元素的物質。A、B分別代表兩種含不同化合價的氯元素的物質(每種物質中氮或氯元素的化合價只有一種)。又知物質M中的氮元素化合價要比物質Q中氮元素的化合價低。在一定條件下,它們會發生如下的轉化(關系式未配平):
①P+A―→Q+B ②L+O2―→M+H2O ③L+M―→R+H2O ④B+H2O―→A+O2
(1)若五種含氮元素的物質中,有一種是硝酸,則硝酸是 ,理由是 。
(2)反應②必須在催化劑(鉑、氧化鐵等)作用下,加熱到一定溫度時方能發生,此反應在化工生產上有重要用途,據此推斷在同溫同壓下,若物質R密度比空氣的密度小,則R的化學式為 。
(3)某同學寫出下面三個含氮的物質相互轉換的關系式:
Ⅰ.M+P―→N2O3+H2O
Ⅱ.N2O4+H2O―→P+Q
Ⅲ.M+L―→Q+H2O
其中一定不可能實現的是 ,理由是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
催化劑是化工技術的核心,絕大多數的化工生產均需采用催化工藝。
⑴人們常用催化劑來選擇反應進行的方向。如圖所示為一定條件下1mol CH3OH與O2發生反應時,生成CO、CO2或HCHO的能量變化圖[反應物O2(g)和生成物H2O(g)略去]。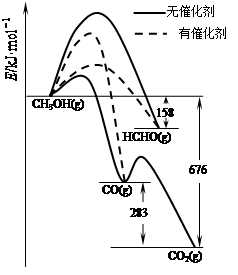
①在有催化劑作用下,CH3OH與O2反應主要生成 (填“CO、CO2或HCHO”)。
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
③在稀硫酸催化下,HCHO可以通過反應生成分子式為C3H6O3的環狀三聚甲醛分子,其分子中同種原子的化學環境均相同。寫出三聚甲醛的結構簡式: 。
④甲醇制取甲醛可用Ag作催化劑,含有AgCl會影響Ag催化劑的活性,用氨水可以溶解除去其中的AgCl,寫出該反應的離子方程式: 。
⑵一種以銅作催化劑脫硫有如下兩個過程:
①在銅的作用下完成工業尾氣中SO2的部分催化氧化,所發生反應為:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O="2n" CuSO4+(2-2n) H2SO4
從環境保護的角度看,催化脫硫的意義為 ;每吸收標準狀況下11.2L SO2,被SO2還原的O2的質量為 g。
②利用下圖所示電化學裝置吸收另一部分SO2,并完成Cu的再生。寫出裝置內所發生反應的離子方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硫單質及其化合物在工農業生產中有著重要的應用。
(1)已知25℃時:SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
則COS(g)生成CO(g)與Sx(s)反應的熱化學方程式是 。
(2)雄黃(As4S4)和雌黃(As2S3)是提取砷的主要礦物原料。已知As2S3和HNO3有如下反應:As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,當生成H3AsO4的物質的量為0.6 mol反應中轉移電子的數目為 ,
(3)向等物質的量濃度Na2S、NaOH混合溶液中滴加稀鹽酸至過量。其中H2S、HS?、S2?的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與滴加鹽酸體積的關系如下圖所示(忽略滴加過程H2S氣體的逸出)。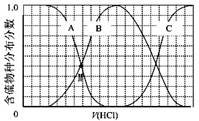
①B表示 。
②滴加過程中,溶液中微粒濃度大小關系正確的是 (填字母)。
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈堿性,當滴加鹽酸至M點時,溶液中各離子濃度由大到小的順序為 。
(4)工業上用硫碘開路循環聯產氫氣和硫酸的工藝流程如下圖所示: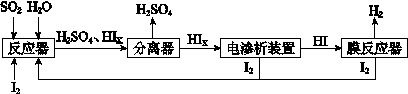
① 寫出反應器中發生反應的化學方程式是 。
② 電滲析裝置如圖所示,寫出陽極的電極反應式 。該裝置中發生的總反應的化學方程式是 。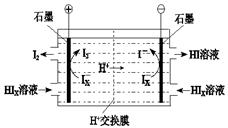
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
溴的氧化性介于氯和碘之間,利用這一性質解決下面的問題。
(1)你認為:將含有下列哪種分子或離子的試劑加入到含有Br-的溶液中,可以將Br-氧化為Br2__________。
| A.I2 | B.I | C.Cl2 | D.Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
脫硫技術能有效控制SO2對空氣的污染。
(1)向煤中加入石灰石可減少燃燒產物中SO2的含量,該反應的化學方程式是
_______________________________。
(2)海水呈弱堿性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42—、Br-、HCO3—等。含SO2的煙氣可利用海水脫硫,其工藝流程如圖所示: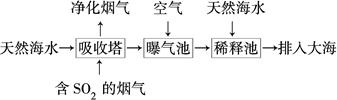
①向曝氣池中通入空氣的目的是_____________________________________。
②通入空氣后曝氣池中海水與天然海水相比,濃度有明顯不同的離子是________。
a.Cl- b.SO42— c.Br- d.HCO3—
(3)用NaOH溶液吸收煙氣中的SO2,將所得的Na2SO3溶液進行電解,可得到NaOH,同時得到H2SO4,其原理如圖所示(電極材料為石墨)。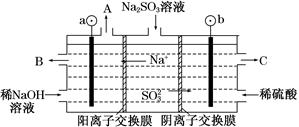
①圖中a極要連接電源的________(填“正”或“負”)極,C口流出的物質是________。
②SO32—放電的電極反應式為____________________________。
③電解過程中陰極區堿性明顯增強,用平衡移動的原理解釋原因:
__________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com