
【題目】下列敘述正確的是
A.晶體熔化時化學鍵一定發生斷裂
B.原子晶體的熔點一定比金屬晶體高
C.含有共價鍵的化合物一定是共價化合物
D.含有離子鍵的化合物一定是離子化合物
科目:高中化學 來源: 題型:
【題目】A,B,C,D,E是位于短周期的主族元素.已知: ①熱穩定性:HmD>HmC;
②Cm﹣、E(m﹣1)具有相同的電子層結構;
③A與B在同一周期,在該周期所有主族元素中,A的原子半徑最大,B的離子半徑最小;
④A與B質子數之和是D質子數的3倍.依據上述信息用相應的化學用語
回答下列問題:
(1)HmDm的電子式為 .
(2)HmC與C元素的具有漂白性的氧化物反應的化學方程式為: , 該反應中氧化產物與還原產物的質量之比為:
(3)用電子式表示C的氫化物的形成過程 , 用電子式表示A2C的形成過程.
(4)在A,B,C,E形成的單質中,符合下列轉化關系的是(填元素符號). ![]()
(5)由A,B,D三種元素形成的化合物與E元素的最高價含氧酸按物質的量之比2:7反應的離子方程式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。反應的平衡常數如下表:
CH3OH(g)。反應的平衡常數如下表:
溫度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常數 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
下列說法正確的是
A. 該反應的△H>0
B. 加壓、增大H2濃度和加入催化劑都能提高CO的轉化率
C. 工業上采用高溫高壓的條件,目的都是提高原料氣的轉化率
D. t℃時,向1 L密閉容器中投入0.1 mol CO和0.2 mol H2,平衡時CO轉化率為50%,則該溫度時反應的平衡常數的數值為100
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一份氣體樣品的質量是14.2 g,體積是4.48 L(標準狀況下),該氣體的摩爾質量是
A. 28.4 g B. 28.4 g·mol-1 C. 71 g·mol-1 D. 14.2 g·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質中既能與強酸反應,又能與強堿反應,且都能生成鹽和水的是( )
①Al ②Al2O3 ③Al(OH)3 ④Na2CO3
A.①③B.②③④C.②③D.全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列除去雜質(括號的物質為雜質)的方法中,錯誤的是( )
A. FeCl3溶液(FeCl2):通入適量Cl2
B. CO(CO2):通過NaOH溶液洗氣后干燥
C. Fe2O3(Al2O3):加入足量NaOH溶液
D. CO2(HCl):通過飽和Na2CO3溶液洗氣后干燥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻鐵礦的主要成分可表示為FeO·Cr2O3,還含有MgO、Al2O3、Fe2O3等雜質,下圖所示是以鉻鐵礦為原料制備重鉻酸鉀(K2Cr2O7)的工藝流程。
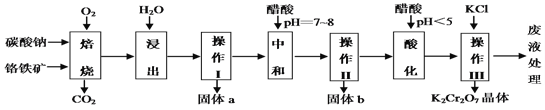
已知1:物質的溶解度(g/100g水)
物質 | 0℃ | 40℃ | 80℃ |
KCl | 28.0 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38.0 |
K2Cr2O7 | 4.7 | 26.3 | 73.0 |
Na2Cr2O7 | 163.0 | 215.0 | 376.0 |
已知2:①焙燒時有Na2CrO4、 Fe2O3 、NaAlO2 等生成。
②Cr2O72- + H2O ![]() 2CrO42- + 2H+ ;
2CrO42- + 2H+ ;
③Cr2O72-具有很強的氧化性
回答問題:
(1)“浸出”步驟中,為了提高浸出率,可采取的措施有加熱、研磨或_______________等(要求寫一條)。
(2)固體b中主要含有______________________(填寫化學式)。
(3)要檢測酸化操作中溶液的pH是否等于4.5,應該使用_______(填寫儀器或用品名稱)。
(4)酸化步驟用醋酸調節溶液的pH﹤5,其目的是____________________;不用鹽酸調節溶液pH的原因是______________________________________。
(5)操作III發生反應的化學方程式是____________________________ ;
(6)寫出焙燒時生成NaAlO2的化學方程式____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com