
【題目】常溫下,在下列溶液中可能大量共存的離子組是( )
A.pH=0的溶液:Fe2+、Mg2+、NO3﹣、SO42﹣
B.由水電離出的c(H+)=1×10﹣13mol/L的溶液:Al3+、K+、SO42﹣、Cl﹣
C.![]() =1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣
=1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣
D.pH=14的溶液:Na+、K+、Al3+、CO32﹣
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W在元素周期表中的相對位置如下圖所示,其中W原子的質子數是其最外層電子數的三倍,下列說法不正確的是( )

A. 原子半徑:W>Z>Y>X
B. 最高價氧化物對應水化物的酸性:X>W>Z
C. 最簡單氣態氫化物的熱穩定性:Y>X>W>Z
D. 元素X、Z、W的最高化合價分別與其主族序數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaOH溶液可用于多種氣體的處理.
(1)CO2是溫室氣體,可用NaOH溶液吸收得到Na2CO3或NaHCO3 . ①Na2CO3俗稱純堿,因CO32﹣水解而使其水溶液呈堿性,寫出CO32﹣第一步水解的離子方程式 . 已知25℃時,CO32﹣第一步水解的平衡常數Kh=2×10﹣4mol/L,當溶液中c(HCO3﹣):c(CO32﹣)=20:1 時,溶液的pH= .
②泡沫滅火器中通常裝有NaHCO溶液和Al2(SO4)3溶液,請寫出這兩種溶液混合時的離子反應方程式 .
(2)金屬與濃硝酸反應產生的NO2可用NaOH溶液吸收,反應方程式為:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液與0.2mol NO2恰好完全反應得1L溶液A,溶液B為0.1molL﹣1CH3COONa溶液,則兩份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的順序為(已知HNO2的電離常數Ka=7.1×10﹣4molL﹣1 , CH3COOH的電離常數Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是 . A.向溶液A中加適量NaOH B.向溶液A中加適量水
C.向溶液B中加適量NaOH D.向溶液B中加適量水
(3)煙氣中的SO2會引起酸雨,可利用氫氧化鈉溶液吸收.吸收SO2的過裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物質的量分數(a)隨pH變化的關系如圖所示: 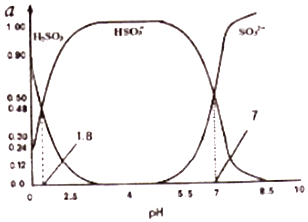
①圖中pH=7時,溶液中離子濃度關系正確的是 .
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣ )+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣ )>c(H+)=c(OH﹣)
②利用上圖中數據,求反應H2SO3=2H++SO32﹣的平衡常數的數值 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按如圖裝置進行實驗,并回答下列問題: 
(1)判斷裝置的名稱:A池為 .
(2)鋅電極反應式為 , 石墨棒C1為極,電極反應式為 , 石墨棒C2附近發生的實驗現象為 .
(3)當C2極析出2.24L氣體(標準狀態)時,鋅的質量減少了g.CuSO4溶液的質量增加了g.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有pH=2的醋酸溶液甲和pH=2的鹽酸乙,請根據下列操作完成問題:
(1)取10mL的甲溶液,加入等體積的水,醋酸的電離平衡(填“向左”、“向右”或“不”)移動;另取10mL的甲溶液,加入少量無水醋酸鈉固體(假設加入固體前后,溶液體積保持不變),待固體溶完后,溶液中 ![]() 的比值將(填“增大”、“減小”或“無法確定”).
的比值將(填“增大”、“減小”或“無法確定”).
(2)相同條件下,取等體積的甲、乙兩溶液,各稀釋100倍.稀釋后的溶液,其pH大小關系為:pH(甲)pH(乙).(填“大于”、“小于”或“等于”,下同)
(3)各取25mL的甲、乙兩溶液,分別用等濃度的NaOH稀溶液中和至pH=7,則消耗的NaOH溶液的體積大小關系為:V(甲)V(乙).
(4)取25mL的甲溶液,加入等體積pH=12的NaOH溶液,反應后溶液中[Na+]、[CH3COO﹣]的大小關系為:[Na+][CH3COO﹣].
(5)取25mL的乙溶液,加入等體積pH=12的氨水,反應后溶液中的溶質為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,尿素電氧化法處理富含尿素的工業廢水和生活污水得到了廣泛關注,該法具有操作簡易、處理量大、運行周期長等優點,且該過程在堿性條件下產生無毒的C02、N2.電池工作時,下列說法錯誤的是( )

A. 負極發生的反應為:![]()
B. 正極附近溶液的pH增大
C. 隔膜只允許陽離子通過
D. 處理掉廢水中尿素1.0g時消耗O2 0.56L(標準狀況)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學選修3:物質結構與性質】
翡翠是玉石中的一種,其主要成分為硅酸鋁鈉-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列問題:
(l)基態Cr原子的電子排布式為____;Fe位于元素周期表的___ 區。
(2)翡翠中主要成分硅酸錨鈉表示為氧化物的化學式為____,其中四種元素第一電離能由小到大的順序是____。
(3)鈣和鐵部是第四周期元素,且原子的最外層電子數相同,為什么鐵的熔沸點遠大于鈣?____。
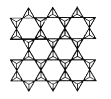
(4)在硅酸鹽中存在![]() 結構單元,其中Si原子的雜化軌道類型為____。當無限多個(用n表示)
結構單元,其中Si原子的雜化軌道類型為____。當無限多個(用n表示)![]() 分別以3個頂角氧和其他3個
分別以3個頂角氧和其他3個![]() 形成層狀結構時(如圖所示),其中Si、O原子的數目之比為____。
形成層狀結構時(如圖所示),其中Si、O原子的數目之比為____。
若其中有一半的Si被Al替換,其化學式為____。
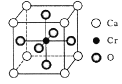
(5) Cr和Ca可以形成種具有特殊導電性的復合氧化物,晶胞結構如圖所示。該晶體的化學式為____,若Ca與O的核間距離為x nm,則該晶體的密度為___ g/cm3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下列裝置說法正確的是( ) 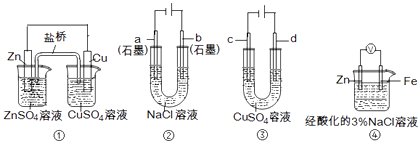
A.裝置①中,鹽橋中的K+移向ZnSO4溶液
B.裝置②工作一段時間后,a極附近溶液的pH增大
C.用裝置③精煉銅時,c極為粗銅
D.裝置④中電子由Zn流向Fe,裝置中有Fe2+生成
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com