
水溶液中存在多種平衡,請(qǐng)回答下列問題。
(1)有下列幾種溶液:a. NH3·H2O b. CH3COONa c. NH4Cl d. NaHSO4
常溫下呈酸性的溶液有 (填序號(hào))。
(2)已知NaHCO3溶液呈堿性,該溶液中除水的電離外還存在著兩個(gè)平衡,用電離方程式或離子方程式表示: 、
,該溶液中的離子濃度由大到小的順序是: 。
(3)有濃度均為0.1 mol?L-1的 ①鹽酸②硫酸③醋酸三種溶液,請(qǐng)用序號(hào)填空:
三種溶液的c(H+)大小順序?yàn)?u> ;中和一定量NaOH溶液生成正鹽時(shí),需上述三種酸的體積依次的大小關(guān)系為 ;若三種溶液的pH都為2,分別取10mL上述溶液加水稀釋至1000mL,此時(shí)三種溶液的pH的大小關(guān)系為 。
(4)25℃時(shí),AgCl的Ksp=1.8×10-10 ,試寫出AgCl溶解平衡的表達(dá)式: ,現(xiàn)將足量AgCl固體投入100mL0.1mol/L MgCl2溶液充分?jǐn)嚢韬罄鋮s到25℃時(shí),此時(shí)c(Ag+)= mol/L(忽略溶液體積的變化)。
(18分)(每空各2分)(1)c.d (2)HCO3- H++CO32- HCO3-+H2O
H++CO32- HCO3-+H2O H2CO3 +OH— c(Na+)>c(HCO32—)>
c(OH—) > c(H+) > c(CO32-)
H2CO3 +OH— c(Na+)>c(HCO32—)>
c(OH—) > c(H+) > c(CO32-)
(3)②>①>③ ①=③>② ①=②>③
(4)AgCl(S) Ag+(aq)+Cl-(aq) 9×10-10
Ag+(aq)+Cl-(aq) 9×10-10
【解析】
試題分析:(1)氨水是弱堿,溶液顯堿性。醋酸鈉溶于水,CH3COO-發(fā)生水解,溶液顯堿性。氯化銨溶于水,NH4+發(fā)生水解,溶液顯酸性。硫酸氫鈉鹽,溶于水,完全電離出氫離子,溶液顯酸性,答案選cd。
(2)碳酸氫鈉是弱酸的酸式鹽,既有HCO3-的水解平衡,也有HCO3-的電離平衡,有關(guān)的離子方程式是HCO3- H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O H2CO3 +OH—。由于水解程度,大于電離程度,所以溶液顯堿性,有關(guān)離子濃度的大小關(guān)系是c(Na+)>c(HCO32—)>
c(OH—) > c(H+) > c(CO32-)。
H2CO3 +OH—。由于水解程度,大于電離程度,所以溶液顯堿性,有關(guān)離子濃度的大小關(guān)系是c(Na+)>c(HCO32—)>
c(OH—) > c(H+) > c(CO32-)。
(3)鹽酸是一元缺少,硫酸是二元強(qiáng)酸,醋酸是一元弱酸,所以在物質(zhì)的量濃度相等的條件下,三種溶液的c(H+)大小順序?yàn)棰?gt;①>③;中和一定量NaOH溶液生成正鹽時(shí),需上述三種酸的體積依次的大小關(guān)系為①=③>②;在稀釋過程中,醋酸內(nèi)繼續(xù)電離出氫離子,所以稀釋后三種溶液的pH的大小關(guān)系為①=②>③。
(4)AgCl溶解平衡的表達(dá)式為AgCl(S) Ag+(aq)+Cl-(aq)。溶液中氯離子的濃度是0.2mol/L,則根據(jù)氯化銀的溶度積常數(shù)可知,溶液中c(Ag+)=
Ag+(aq)+Cl-(aq)。溶液中氯離子的濃度是0.2mol/L,則根據(jù)氯化銀的溶度積常數(shù)可知,溶液中c(Ag+)=
考點(diǎn):考查溶液酸堿性的判斷、碳酸氫鈉的水解和電離、弱電解質(zhì)的電離平衡以及溶度積常數(shù)的有關(guān)計(jì)算和應(yīng)用
點(diǎn)評(píng):該題是中等難度的試題,試題注重基礎(chǔ)性知識(shí)的檢查和鞏固。該題考查的知識(shí)點(diǎn)比較分散,主要是圍繞弱電解質(zhì)的電離平衡和溶解平衡展開的,有利于培養(yǎng)學(xué)生的邏輯思維能力和發(fā)散思維能力,提高學(xué)生分析問題、歸納、總結(jié)問題的能力。


 小題狂做系列答案
小題狂做系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:閱讀理解
| 資料:①H2S可溶于水(約1:2),其水溶液為二元弱酸. ②H2S可與許多金屬離子反應(yīng)生成沉淀. ③H2S在空氣中燃燒,火焰呈淡藍(lán)色. |
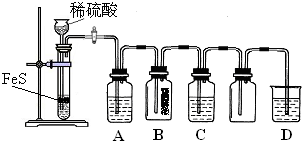
| 實(shí)驗(yàn)操作 | 實(shí)驗(yàn)現(xiàn)象 | |
| 實(shí)驗(yàn)1 | 將等濃度的Na2S和Na2SO3溶液按體積比2:1混合 | 無明顯現(xiàn)象 |
| 實(shí)驗(yàn)2 | 將H2S通入Na2SO3溶液中 | 未見明顯沉淀,再加入少量稀硫酸,立即產(chǎn)生大量淺黃色沉淀 |
| 實(shí)驗(yàn)3 | 將SO2通入Na2S溶液中 | 有淺黃色沉淀產(chǎn)生 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:閱讀理解
 通過實(shí)驗(yàn)測(cè)定反應(yīng)速率的方法有多種,為證明化學(xué)反應(yīng)速率與反應(yīng)的濃度有關(guān).有同學(xué)設(shè)計(jì)如下實(shí)驗(yàn):
通過實(shí)驗(yàn)測(cè)定反應(yīng)速率的方法有多種,為證明化學(xué)反應(yīng)速率與反應(yīng)的濃度有關(guān).有同學(xué)設(shè)計(jì)如下實(shí)驗(yàn):| 序號(hào) | Na2S2O3溶液 | 稀H2SO4 | 出現(xiàn)混濁時(shí)間 | ||
| 濃度 | 用量 | 濃度 | 用量 | ||
| (1) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 10mL | t1 |
| (2) | 0.1mol?L-1 | 10mL+5mL 水 | 0.1mol?L-1 | 10mL | t2 |
| (3) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 5mL+5mL水 | t3 |
| (4) | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 5mL | t4 |
查看答案和解析>>
科目:高中化學(xué) 來源:2012-2013年黑龍江哈爾濱第十二中學(xué)高二上學(xué)期期末考試化學(xué)試卷(帶解析) 題型:填空題
水溶液中存在多種平衡,請(qǐng)回答下列問題。
(1)有下列幾種溶液:a. NH3·H2O b. CH3COONa c. NH4Cl d. NaHSO4
常溫下呈酸性的溶液有 (填序號(hào))。
(2)已知NaHCO3溶液呈堿性,該溶液中除水的電離外還存在著兩個(gè)平衡,用電離方程式或離子方程式表示: 、
,該溶液中的離子濃度由大到小的順序是: 。
(3)有濃度均為0.1 mol?L-1的 ①鹽酸②硫酸③醋酸三種溶液,請(qǐng)用序號(hào)填空:
三種溶液的c(H+)大小順序?yàn)?u> ;中和一定量NaOH溶液生成正鹽時(shí),需上述三種酸的體積依次的大小關(guān)系為 ;若三種溶液的pH都為2,分別取10mL上述溶液加水稀釋至1000mL,此時(shí)三種溶液的pH的大小關(guān)系為 。
(4)25℃時(shí),AgCl的Ksp=1.8×10-10 ,試寫出AgCl溶解平衡的表達(dá)式: ,現(xiàn)將足量AgCl固體投入100mL0.1mol/L MgCl2溶液充分?jǐn)嚢韬罄鋮s到25℃時(shí),此時(shí)c(Ag+)= mol/L(忽略溶液體積的變化)。
查看答案和解析>>
科目:高中化學(xué) 來源:2012-2013學(xué)年四川省涼山州高三第二次診斷性測(cè)試?yán)砭C化學(xué)試卷(解析版) 題型:實(shí)驗(yàn)題
2012年10月8日發(fā)布的修訂版《機(jī)動(dòng)車駕駛證申領(lǐng)和使用規(guī)定》,以其對(duì)違章駕駛員的嚴(yán)厲懲罰被人們稱為“史上最嚴(yán)交規(guī)”,其中飲酒后駕駛機(jī)動(dòng)車的一次記12分。利用如下測(cè)試管可檢測(cè)司機(jī)是否酒后駕車,化學(xué)原理如下:

金屬鉻在化合物中主要有+3價(jià)和+6價(jià)兩種價(jià)態(tài)。+6價(jià)鉻化合物K2CrO4和K2Cr2O7在水溶液中分別呈黃色和橙色,它們?cè)谌芤褐写嬖谌缦缕胶怅P(guān)系:2CrO42-+2H+ Cr2O72-+H2O在酸性條件下+6價(jià)鉻化合物具有強(qiáng)氧化性,可以將C2H5OH氧化為CH3COOH,本身被還原為Cr3+,Cr3+在水溶液中呈灰綠色。
Cr2O72-+H2O在酸性條件下+6價(jià)鉻化合物具有強(qiáng)氧化性,可以將C2H5OH氧化為CH3COOH,本身被還原為Cr3+,Cr3+在水溶液中呈灰綠色。
(1)根據(jù)上述條件可知,在強(qiáng)酸性條件下+6價(jià)鉻主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司機(jī)酒后駕車,則測(cè)試管中的現(xiàn)象是 且超過法定警界線,反應(yīng)的離子方程式為 。
(2)研究發(fā)現(xiàn)+6價(jià)鉻的毒性為+3價(jià)鉻的毒性的100~200倍,有多種方法可以將廢水中的+6價(jià)鉻轉(zhuǎn)化為+3價(jià)鉻以降低毒性。其中兩種方法如下:
方法一:電化學(xué)方法。將含Cr2O2-7的酸性廢水加適量NaCl攪拌均勻并以Fe作電極進(jìn)行電解。在陽極產(chǎn)生的Fe2+將Cr2O2-7還原為Cr3+,在電解過程中溶液的pH不斷上升,最終Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。
①請(qǐng)分析溶液pH不斷上升的原因: 。
②已知Fe3+和Cr3+變?yōu)镕e(OH)3和Cr(OH)3沉淀的pH如下表:

當(dāng)溶液的pH范圍為____時(shí),溶液中Fe3+已沉淀完全而Cr3+還沒有開始沉淀。
③當(dāng)電路中通過3mol電子時(shí),理論可還原Cr2O2-7的物質(zhì)的量為 mol。
方法二:還原沉淀法。將l0ml某含鉻(Cr2O2-7)廢水用硫酸亞鐵銨[FeSO4·(NH4)2SO4·6H2O]處理,反應(yīng)中鐵元素和鉻元素完全轉(zhuǎn)化為沉淀,該沉淀經(jīng)干燥后為nmolFeO·FeyCrxO3。
④不考慮處理過程中的實(shí)際損耗,下列敘述錯(cuò)誤的是
A.反應(yīng)中發(fā)生轉(zhuǎn)移的電子個(gè)數(shù)為3nx
B.該廢水中c(Cr2O2-7)為50nx mol/L
C.消耗硫酸亞鐵銨的物質(zhì)的量為n(l+y)mol
D.在FeO·FeyCrxO3中,x+y=2
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com