
能源問題是人類社會面臨的重大課題,甲醇是一種可再生能源,具有開發和應用的廣闊前景,研究甲醇具有重要意義。
(1)用CO合成甲醇的反應為:CO(g)+2H2(g)  CH3OH(g)在容積為1L。的密閉容器中分別充入1molCO和2molH2,實驗測得甲醇的物質的量和溫度、時間的關系曲線如圖所示。則該正反應的△H_______0(填“<”、“>”或“=”),判斷的理由是______。
CH3OH(g)在容積為1L。的密閉容器中分別充入1molCO和2molH2,實驗測得甲醇的物質的量和溫度、時間的關系曲線如圖所示。則該正反應的△H_______0(填“<”、“>”或“=”),判斷的理由是______。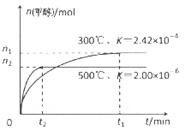
(2)利用工業廢氣中的CO2可制取甲醇,其反應為:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常溫常壓下已知下列反應的能量變化如下圖所示:
由二氧化碳和氫氣制備甲醇的熱化學方程式為_______。
②為探究用CO2生產燃料甲醇的反應原理,現進行如下實驗:在一恒溫恒容密閉容器中,充入1molCO2和3molH2,進行上述反應。測得CO2。和CH3OH(g)的濃度隨時間變化如圖所示。從反應開始到平衡,v(H2)="_______" ;該溫度下的平衡常數數值K=______。能使平衡體系中n(CH3OH)/n(CO2))增大的措施有_______(任寫一條)。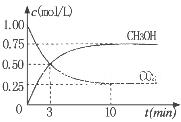
(3)工業上利用甲醇制備氫氣的常用方法有兩種。
①甲醇蒸汽重整法。主要反應為;CH3OH(g)  CO(g)+2H2(g)設在容積為2.0L的密閉容器中充入0. 60 molCH3OH(g),體系壓強為P1,在一定條件下達到平衡時,體系壓強為P2,且P2/P1 =2.2,則該條件下CH3OH 的平衡轉化率為______ 。
CO(g)+2H2(g)設在容積為2.0L的密閉容器中充入0. 60 molCH3OH(g),體系壓強為P1,在一定條件下達到平衡時,體系壓強為P2,且P2/P1 =2.2,則該條件下CH3OH 的平衡轉化率為______ 。
②甲醇部分氧化法。在一定溫度下以Ag/CeO2-ZnO為催化劑時原料氣比例對反應的選擇性(選擇性越大,表示生成的該物質越多)影響關系如圖所示。則當n(O2)/n(CH3OH) =0.25時。CH3OH與O2發生的主要反應方程式為______ 。在制備H2:時最好控制n(O2))/n(CH3OH)=______。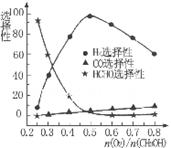
(1)<溫度升高,平衡時甲醇的量減少,平衡逆向移動,則正反應放熱(或溫度升高,平衡常數減小,平衡逆向移動,則正反應放熱)。(2)① CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH="-50KJ/mol." ②0.225mol/(L·min) 5.3 降低溫度(或加壓或增大H2的量或將H2O蒸汽從體系中分離等)。(3) ①60﹪ ②2CH3OH+O2 ="2HCHO+" 2H2O 0. 5
解析試題分析:(1)當反應達到平衡后,由于升高溫度,n(CH3OH)減小,平衡時CH3OH的含量降低,說明升高溫度,化學平衡向逆反應方向移動。根據平衡移動原理,升高溫度,化學平衡向吸熱反應方向移動。逆反應方向是吸熱反應,所以正反應是放熱反應。故△H<0.(2) ①由圖一可知:CO2(g)+H2(g)=CO(g)+H2O(l) △H="41KJ/mol," 由圖二可知:CO(g)+2H2(g)  CH3OH(g) △H= -91KJ/mol.將兩式相加可得:CO2(g) +3H2(g)=CH3OH(l)+H2O(l) ΔH="-50KJ/mol." ② V(CO2)=" (1.00-0.25)" mol/L÷10min=" 0.075mol/(l·min)." V(H2):V(CO2)=3:1,所以V(H2)="3" V(CO2)=" 0.225mol/(L·min)" . 在該溫度下的平衡常數數值
CH3OH(g) △H= -91KJ/mol.將兩式相加可得:CO2(g) +3H2(g)=CH3OH(l)+H2O(l) ΔH="-50KJ/mol." ② V(CO2)=" (1.00-0.25)" mol/L÷10min=" 0.075mol/(l·min)." V(H2):V(CO2)=3:1,所以V(H2)="3" V(CO2)=" 0.225mol/(L·min)" . 在該溫度下的平衡常數數值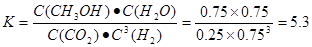 由于反應 CO2(g) +3H2(g)= CH3OH(l)+H2O(l) ΔH=-50KJ/mol.的正反應是一個放熱反應,所以降低溫度能使平衡體系中n(CH3OH)/n(CO2)增大。另外比如加壓、增加H2的量或將水蒸氣從混合物中分離出來等措施也能使平衡體系中n(CH3OH)/n(CO2))增大。(3)反應開始時n(CH3OH)=0.6mol,n(CO)=0mol,n(H2)=0mol.假設反應過程中CH3OH改變的物質的量為X,則達到平衡時各物質的物質的量為n(CH3OH)=" (0.6-X)mol," n(CO) ="Xmol" n(H2)=2Xmol,對于體積固定的密閉容器中的氣體反應來說,反應前后的壓強比等于它們的物質的量的比。所以(0.6+2X)÷0.6=2.2,解得X=0.36.所以CH3OH的平衡轉化率為0.36÷0.6×100﹪=60﹪。②由圖可知當n(O2)/n(CH3OH) =0.25時得到的產物是甲醛,CH3OH與O2發生的主要反應方程式為2CH3OH +O2="2HCHO+" 2H2O。在制備H2時由于在n(O2)/n(CH3OH) =0.5時選擇性最高,所以最好控制n(O2))/n(CH3OH)= 0.5。
由于反應 CO2(g) +3H2(g)= CH3OH(l)+H2O(l) ΔH=-50KJ/mol.的正反應是一個放熱反應,所以降低溫度能使平衡體系中n(CH3OH)/n(CO2)增大。另外比如加壓、增加H2的量或將水蒸氣從混合物中分離出來等措施也能使平衡體系中n(CH3OH)/n(CO2))增大。(3)反應開始時n(CH3OH)=0.6mol,n(CO)=0mol,n(H2)=0mol.假設反應過程中CH3OH改變的物質的量為X,則達到平衡時各物質的物質的量為n(CH3OH)=" (0.6-X)mol," n(CO) ="Xmol" n(H2)=2Xmol,對于體積固定的密閉容器中的氣體反應來說,反應前后的壓強比等于它們的物質的量的比。所以(0.6+2X)÷0.6=2.2,解得X=0.36.所以CH3OH的平衡轉化率為0.36÷0.6×100﹪=60﹪。②由圖可知當n(O2)/n(CH3OH) =0.25時得到的產物是甲醛,CH3OH與O2發生的主要反應方程式為2CH3OH +O2="2HCHO+" 2H2O。在制備H2時由于在n(O2)/n(CH3OH) =0.5時選擇性最高,所以最好控制n(O2))/n(CH3OH)= 0.5。
考點:考查關于甲醇燃料電池的化學反應原理及制法等知識。


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:填空題
硫-碘循環分解水制氫主要涉及下列反應:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI
Ⅱ.2HI H2↑+I2
H2↑+I2
Ⅲ.2H2SO4=2SO2+O2↑+2H2O
(1)分析上述反應,下列判斷正確的是 。
a.反應Ⅲ易在常溫下進行
b.反應Ⅰ中SO2氧化性比HI強
c.循環過程中需補充H2O
d.循環過程中產生1 mol O2的同時產生1 mol H2
(2)一定溫度下,向1 L密閉容器中加入1 mol HI(g),發生反應Ⅱ,H2的物質的量隨時間的變化如圖所示。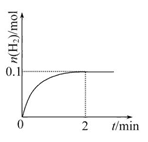
①0~2 min內的平均反應速率v(HI)= 。
②相同溫度下,若開始加入HI(g)的物質的量是原來的2倍,則 是原來的2倍。
a.HI的平衡濃度
b.達到平衡的時間
c.平衡時H2的體積分數
(3)實驗室用Zn和稀硫酸制取H2,若加入少量下列固體試劑中的 ,產生H2的速率將增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某興趣小組探究以芒硝Na2SO4·10H2O和CaO為原料制備Na2CO3。
(1)將CaO水化后,與芒硝形成Na2SO4-Ca(OH)2-H2O三元體系,反應后過濾,向濾液中通入CO2,期望得到Na2CO3。三元體系中反應的離子方程式為: SO42-+ Ca(OH)2(s)+2H2O CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
該反應的平衡常數表達式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元體系中添加適量的某種酸性物質,控制pH="12.3" [即c(OH-)=0.02mol/L],可使反應在常溫下容易進行。反應后過濾,再向濾液中通入CO2,進一步處理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元體系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物質須滿足的條件(寫出兩點)是_____________、______________。
(4)用平衡移動原理解釋添加酸性物質的理由:____________________________________;以HA表示所添加的物質,則總反應的離子方程式可寫為_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O HCO3-+OH-。下列說法錯誤的是_________。
HCO3-+OH-。下列說法錯誤的是_________。
a.加水稀釋,溶液中所有離子的濃度都減小
b.通入CO2,溶液pH減小
c.加入NaOH固體,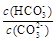 減小
減小
d.稀釋溶液,平衡常數增大
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氮氣與氫氣反應生成氨氣的平衡常數見下表:
| | N2+3H2 2NH3 2NH3 | |||
| 溫度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常數K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知2A2(g) + B2(g) 2C(g)
2C(g)  H=" -a" kJ/mol(a>0),在一個有催化劑的固定容積的密閉容器中加入2molA2和1molB2,在500℃是充分反應達到平衡后C的濃度為w mol/L,放出熱量b kJ。
H=" -a" kJ/mol(a>0),在一個有催化劑的固定容積的密閉容器中加入2molA2和1molB2,在500℃是充分反應達到平衡后C的濃度為w mol/L,放出熱量b kJ。
(1)a b(填“>”“=”或“<”)。
(2)若將反應溫度升高到700℃,該反應的平衡常數將 (填“增大”“減小”或“不變”)。
(3)若在原來的容器中,只加入2mol C,500℃時充分反應達到平衡后,吸收熱量c kJ,C的濃度 w mol/L(填“>”“=”或“<”),a,b,c之間滿足何種關系: (用等式表示)。
(4)能說明該反應已經達到平衡的狀態的是 。
a.ν(C)=2ν(B2) b.容器內壓強保持不變
c.ν(逆)(A2)=ν(正)(B2) d.容器內的密度保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某研究小組對一元有機弱酸HA在溶劑苯和水的混合體系中的溶解程度進行研究。在25℃時,弱酸HA在水中部分電離,當HA濃度為 時,其電離度為0.20(電離度=已電離的HA分子數/起始HA的總分子數);在苯中部分發生雙聚,生成(HA)2。該平衡體系中,一元有機弱酸HA在溶劑苯(B)和水(W)中的分配系數為K,K=C(HA)B/C(HA)W=1.0,即達到平衡后,以分子形式存在的HA在苯和水兩種溶劑中的比例為1:1;其他信息如下:
時,其電離度為0.20(電離度=已電離的HA分子數/起始HA的總分子數);在苯中部分發生雙聚,生成(HA)2。該平衡體系中,一元有機弱酸HA在溶劑苯(B)和水(W)中的分配系數為K,K=C(HA)B/C(HA)W=1.0,即達到平衡后,以分子形式存在的HA在苯和水兩種溶劑中的比例為1:1;其他信息如下:
| 25℃平衡體系 | 平衡常數 | 焓變 | 起始總濃度 |
在水中,HA 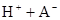 | 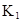 | 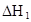 |  |
在苯中,2HA 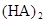 | 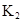 | 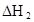 | 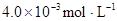 |
 (HA)2,反應在較低溫度下自發進行,則
(HA)2,反應在較低溫度下自發進行,則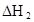 ___________0。
___________0。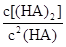 =130,則反應向___________方向進行。
=130,則反應向___________方向進行。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ.(4分)在一體積為10L密閉的容器中,通入一定量的CO和H2O(g),在850℃時發生如下反應:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
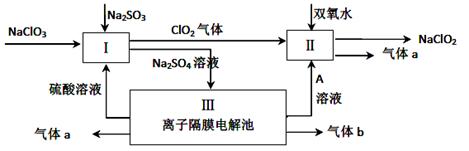
(1)CO和H2O濃度變化如圖,則0~4 min的平均反應速率ν(CO)=_______ mol/(L·min),此時該反應的平衡常數為 。 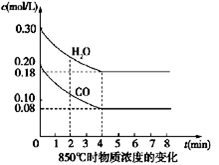
(2)當下列哪些物理量不再發生變化時,表明上述反應已達到平衡狀態的是 。
| A.混合氣體的壓強 |
| B.混合氣體的密度 |
| C.CO的物質的量濃度 |
| D.密閉容器中放出熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氨氣是一種重要的化工產品,是生產銨鹽、尿素等的原料。工業合成氨的反應如下:N2(g) +3H2(g)  2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密閉容器中達到平衡的標志有
N2(g) +3H2(g)在恒容密閉容器中達到平衡的標志有
①單位時間內生成3n mol H2:同時生成2n mol NH3②用NH3、N2、H2表示反應速率比為2∶1∶3 ③混合氣體的密度不再改變 ④混合氣體壓強不再改變 ⑤混合氣體平均相對分子質量不再改變
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
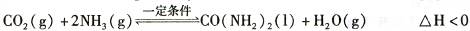
| 時間/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2) /mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
以CO2為碳源制取低碳有機物成為國際研究焦點,下面為CO2加氫制取乙醇的反應: 2CO2(g)+6H2(g)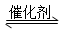 CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)
在密閉容器中,按H2與CO2的物質的量之比為3:1進行投料,在5MPa下測得不同溫度下平衡體系中各種物質的體積分數(y%)如下圖所示。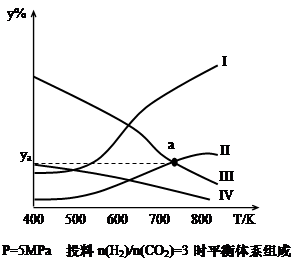
完成下列填空:
(1)表示CH3CH2OH體積分數曲線的是_______(選填序號)
(2)在一定溫度下反應達到平衡的標志是_______(選填編號)
a.平衡常數K不再增大
b.CO2的轉化率不再增大
c.混合氣體的平均相對分子質量不再改變
d.反應物不再轉化為生成物
(3)其他條件恒定,如果想提高CO2的反應速率,可以采取的反應條件是_______(選填編號);達到平衡后,能提高H2轉化率的操作是_______(選填編號)
a.降低溫度 b.充入更多的H2
c.移去乙醇 d.增大容器體積
(4)圖中曲線II和III的交點a對應的體積分數ya=_______%
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com