
工業上常用鐵質容器盛裝冷濃硫酸。為研究鐵質材料與熱濃硫酸的反應,某學習小組進行了以下探究活動:
(1)將已去除表面氧化物的鐵釘(碳素鋼)放入冷濃硫酸中,10分鐘后移入硫酸銅溶液中,片刻后取出觀察,鐵釘表面無明顯變化,其原因是 。
(2)另稱取鐵釘6.0g放入15.0ml濃硫酸中,加熱,充分應后得到溶液X并收集到氣體Y。
①甲同學認為X中除Fe3+外還可能含有Fe2+,若要確認其中的Fe2+,應選用 (選填序號)。
a.KSCN溶液和氯水 b.NaOH溶液
c.濃氨水 d.酸性KMnO4溶液
②乙同學取336ml(標準狀況)氣體Y通入足量溴水中,發生反應:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,經適當操作后得干燥固體2.33g。由此推知氣體Y中SO2的體積分數為 。
分析上述實驗中SO2體積分數的結果,丙同學認為氣體Y中還可能含有H2和Q氣體。為此設計了下列探究實驗裝置(圖中夾持儀器省略)。
(3)裝置B中試劑的作用是 。
(4)認為氣體Y中還含有Q的理由是 (用化學方程式表示)。
(5)為確認Q的存在,需在裝置中添加M于 (選填序號)。
a.A之前 b.A-B間 c.B-C間 d.C-D間
(6)如果氣體Y中含有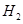 ,預計實驗現象應是 。
,預計實驗現象應是 。
(1)鐵釘表面形成致密的氧化物薄膜,阻止鐵和硫酸銅反應(或其他合理答案)
(2)①d ②66.7%(或其他合理答案)
(3)檢驗SO2是否除盡
(4)C+2H2SO4(濃) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)c
(6)D中固體由黑變紅和E中固體由白變藍
解析試題分析:(1)鐵釘(碳素鋼)放入冷濃硫酸中,濃硫酸有強氧化性,能使鐵釘鈍化,表面形成致密的氧化物薄膜,而阻止反應進一步進行。
(2)①+2價亞鐵離子能使酸化的高錳酸鉀溶液褪色,故d項正確;溶液中已經有+3價鐵離子,選項a會造成干擾;選項b、c生成兩種沉淀,受氫氧化鐵沉淀顏色的影響無法分辨。
②根據化學方程式可得n(SO2)=n(H2SO4)=n(BaSO4)=2.33g÷233g/mol=0.01mol,氣體Y中SO2的體積分數為:0.01mol×22.4L/mol÷0.336L=66.7%。
(3)裝置B中為品紅溶液,作用為:檢驗SO2是否除盡。
(4))在加熱時,鐵釘中不僅鐵和濃硫酸反應,碳也和濃硫酸反應生成生成二氧化硫、二氧化碳和水,反應方程式為C+2H2SO4(濃) CO2+2SO2+2H2O。
CO2+2SO2+2H2O。
(5)Q為二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水變渾濁,選擇a或b受二氧化硫的影響無法判斷二氧化碳的存在,選d時二氧化碳被堿石灰吸收,故選C。
(6)氫氣還原氧化銅會生成水蒸氣,能使白色的硫酸銅粉末變藍色,同時有紅色的銅單質生成。
考點:本題考查金屬的鈍化、Fe2+的檢驗、根據化學方程式的計算、試劑的選擇與作用、實驗現象的分析。


科目:高中化學 來源: 題型:填空題
電子工業常用30%的FeCl3溶液腐蝕敷在絕緣板上的銅箔,制造印刷電路板。
(1)FeCl3溶液與金屬銅發生反應的離子方程式是 。
(2)檢驗溶液中Fe3+存在的操作步驟和現象是 。
(3)某工程師為了從使用過的腐蝕廢液中回收銅,并重新獲得氯化鐵溶液,準備采用下列步驟: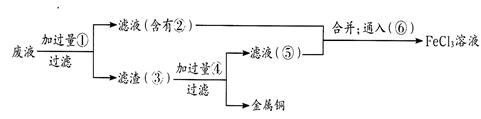
上述實驗中加入或生成的有關物質的化學式為② ④____________
通入⑥得到FeCl3溶液的離子反應方程式為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上利用廢鐵屑(含少量氧化鋁、氧化鐵等)生產堿式硫酸鐵[Fe(OH)SO4]的工藝流程如下: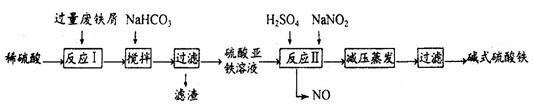
已知:部分陽離子以氫氧化物形式沉淀時溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
從鋁土礦(主要成分是Al2O3,含SiO2、Fe2O3、MgO等雜質)中提取兩種工藝的流程如下:
請回答下列問題:
(1)流程甲加入鹽酸后生成Al3+的方程式為____________________________.
(2)流程乙加入燒堿后生成SiO32—的離子方程式為______________________.
(3)驗證濾液B含Fe3+,可取少量濾液并加入________(填試劑名稱)。
(4)濾液E、K中溶質的主要成份是____________(填化學式),寫出該溶液的一種用途____________
(5)已知298K時,Mg(OH)2的溶度積常數KSP=5.6×10—12,取適量的濾液B,加入一定量的燒堿達到沉淀溶液平衡,測得PH=13.00,則此溫度下殘留在溶液中的c(Mg2+)=__________________.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
目前,鐵是使用最廣泛的金屬之一,已知在高溫下,Fe與水蒸氣可發生反應。
應用下列裝置,在硬質玻璃管中放入還原鐵粉和石棉絨的混合物,加熱,并通入水蒸氣,就可以完成高溫下“Fe與水蒸氣的反應實驗”。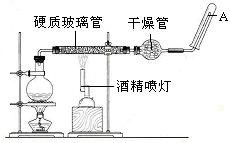
請回答下列的問題。
鐵在周期表中的位置是_______
請寫出該反應的化學方程式: ;
(3)曾利用鋁和鐵的氧化物反應原理來焊接鋼軌,該反應的化學方程式為
(4)現有鐵和鉑組成的合金共a mol,其中Pt的物質的量分數為x,研成粉末狀后全部投入含bmol HNO3的稀溶液中,使其充分反應,且HNO3的還原產物只有NO。試回答下列問題:
①隨HNO3用量的增加,溶液中的金屬離子和殘留固體的成分依次有四種情況,請用粒子符號填寫下表空白:
| | ① | ② | ③ | ④ |
| 溶液中的金屬離子 | | Fe2+ | | |
| 殘留固體成分 | Fe、Pt | | Pt | Pt |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
孔雀石主要含Cu2(OH)2CO3,還含少量Fe、Si的化合物。實驗室以孔雀石為原料制備 CuSO4·5H2O及納米材料G,步驟如下:
請回答下列問題:
(1)溶液A的金屬離子有Cu2+、Fe2+、Fe3+。從下列所給試劑中選擇:實驗步驟中試劑①最佳為_____(填代號)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
向溶液B中加入CuO的作用是 。
(2)由溶液C獲得CuSO4·5H2O,需要經過 、過濾等操作。除燒杯、漏斗外,過濾操作還用到另一玻璃儀器,該儀器在此操作中的主要作用是 。
(3)寫出制備G的化學反應方程式。若實驗過程中有氨氣逸出,應選用下列 裝置回收(填代號)。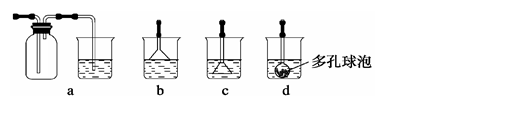
(4)欲測定溶液A中Fe2+的溶液,可用KMnO4標準溶液滴定,取用KMnO4標準溶液應使用 。取A溶液稀釋一定倍數后,用KMnO4標準溶液滴定,終點現象為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
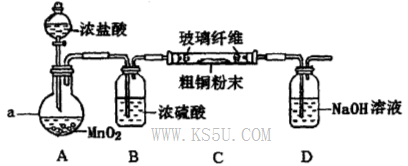
氯化銅是一種廣泛用于生產顏料、用木材防腐劑的化工產品。某研究性學習小組用粗銅(含雜質Fe)按下述流程制備氯化銅晶體。
(1)固體A用稀鹽酸溶解而不用水溶解的原因是________。
(2)加試劑X用于調節pH以除去雜質,X可選用下列試劑中的____(填序號)。
| A.NaOH | B.NH3.H2O | C.CuO | D.Cu(OH)2E. CuSO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲、乙兩同學在實驗室分別取用不同試劑來制取Al(OH)3【可選試劑有:AlCl3溶液、A12(SO4)3溶液、NaOH溶液、氨水】。
(1)請完成下表:
| | 甲同學 | 乙同學 |
| 選用試劑 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至過量 | 向A12(SO4)3溶液中逐滴加入氨水至過量 |
| 實驗現象 | | |
| 化學方程式 | | A12(SO4)3+6NH3·H2O=2A1(OH)3 ↓+3(NH4)2SO4 |
| 離子方程式 | | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
ZnO具有抗菌性,也是重要的輪胎添加劑。工業上由粗ZnO(含FeO、CuO)制備活性ZnO流程如下: 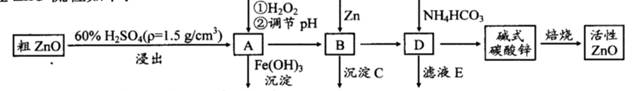
已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氫氧化物的pH如下表:
| 離子 | 開始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com