
【題目】一定溫度下,在3個體積均為1.0 L的恒容密閉容器中反應2H2(g)+CO(g)![]() CH3OH(g) 達到平衡。下列說法正確的是
CH3OH(g) 達到平衡。下列說法正確的是

A.該反應的正反應放熱
B.達到平衡時,容器Ⅰ中反應物轉化率比容器Ⅱ中的大
C.達到平衡時,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的兩倍
D.達到平衡時,容器Ⅲ中的正反應速率比容器Ⅰ中的大
【答案】AD
【解析】A、分析Ⅰ、Ⅲ中數據知反應開始時Ⅰ中加入的H2、CO與Ⅲ中加入甲醇的物質的量相當,平衡時甲醇的濃度:Ⅰ>Ⅲ,溫度:Ⅰ<Ⅲ,即升高溫度平衡逆向移動,該反應正向為放熱反應,A正確;B、Ⅱ相當于將容器Ⅰ的體積縮小二分之一,該反應正向為氣體物質的量減小的反應,增大壓強平衡正向移動,達到平衡時,容器Ⅰ中反應物轉化率比容器Ⅱ中的小,b錯誤;C、Ⅰ和Ⅱ對比,Ⅱ相當于將容器Ⅰ的體積縮小二分之一,該反應正向為氣體物質的量減小的反應,增大壓強平衡正向移動,則Ⅱ中氫氣的濃度小于Ⅰ中氫氣濃度的2倍,Ⅲ和Ⅰ對比,平衡逆向移動,氫氣濃度增大,故達到平衡時,容器Ⅱ中c(H2)小于容器Ⅲ中c(H2)的兩倍,c錯誤;D、溫度:Ⅲ>Ⅰ,當其他條件不變時,升高溫度反應速率加快,故達到平衡時,容器Ⅲ中的正反應速率比容器Ⅰ中的大,d正確。答案選AD。


 導學全程練創優訓練系列答案
導學全程練創優訓練系列答案科目:高中化學 來源: 題型:
【題目】按物質的組成進行分類,HNO3應屬于( )
①酸 ②氧化物 ③含氧酸 ④一元酸 ⑤化合物
A. ①②③④⑤ B. ①③⑤ C. ①②③⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】正硼酸(H3BO3)是一種片層狀結構白色晶體,層內的H3BO3分子通過氫鍵相連(如下圖)。下列有關說法正確的有
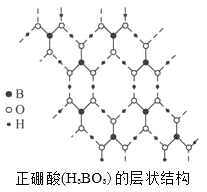
A. 在H3BO3分子中各原子最外層全部滿足8電子穩定結構
B. H3BO3分子的穩定性與氫鍵有關
C. 1mol H3BO3的晶體中有3mol極性共價鍵
D. 1mol H3BO3的晶體中有3mol氫鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素X的某價態離子Xn+中所有電子正好充滿K、L、M三個電子層,它與N3-形成的晶體結構如下圖所示。下列說法錯誤的是

A. X元素的原子序數是19
B. Xn+中n=1
C. 該晶體中陽離子與陰離子個數比為3∶1
D. 晶體中每個N3-周圍有6個等距離且最近的Xn+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MnO2是常見的氧化劑、催化劑和活性電極材料。
(1)工業上,以惰性材料為電極,電解MnSO4溶液(含少量稀硫酸)制備MnO2。寫出陽極的電極反應式:___________。
(2)已知如下熱化學方程式(K代表平衡常數):
①MnCO3(s)![]() MnO(s)+CO2(g) △H1 K1
MnO(s)+CO2(g) △H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s) △H2 K2
2MnO2(s) △H2 K2
③2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g) △H3 K3
2MnO2(s)+2CO2(g) △H3 K3
△H3=______(用△H1、△H2表示) K3=_______(用K1、K2表示)。
(3)反應②在低溫條件下能自發進行,則△H2______0(填“>”“<”或“=”)。
(4)在密閉容器中投入足量的MnCO3,—定條件下發生反應:MnCO3(s)![]() MnO(s)+CO2(g)
MnO(s)+CO2(g)
△H>0。在一定溫度下,達到平衡狀態時p(CO2)=2a MPa。

① 溫度、壓強對MnCO3分解率的影響如圖所示:比較:L1____L2(填“>”“<”或“=”)。
② 保持溫度不變,將容器體積擴大至原來的2倍,則p(CO2)的變化范圍是______。
③ 保持溫度不變,將容器體積壓縮至原來的一半,達到新平衡時下列物理量-定不變的是__(填代號)。
A.平衡常數K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)—定溫度下,在容積為2L的恒容密閉容器中加人足量的MnCO3(s)和5molO2,發生反應:2MnCO(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1經過10min達到平衡狀態。該條件下該反應的平衡常數K為_______。
2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1經過10min達到平衡狀態。該條件下該反應的平衡常數K為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一氧化碳是一種用途相當廣泛的化工基礎原料。
⑴. 利用下列反應可以將粗鎳轉化為純度達99.9%的高純鎳。
Ni(s)+4CO(g)![]() Ni(CO)4(g) 該反應的ΔH_______0(選填“>”或“=”或“<”)。
Ni(CO)4(g) 該反應的ΔH_______0(選填“>”或“=”或“<”)。
⑵. 在高溫下一氧化碳可將二氧化硫還原為單質硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
則2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH4=________。
⑶. 工業上一般采用CO與H2反應合成可再生能源甲醇,反應如下:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應達到平衡后,測
得c(CO)=0.2mol·L-1,則CO的轉化率為___________。
合成氣經壓縮升溫后進入10m3甲醇合成塔,在催化劑作用下,通過反應進行甲醇合成,T1℃下此反應的平衡常數為160。此溫度下,在密閉容器中加入一定量CO和H2,反應到某時刻測得各組分的濃度如下:
物質 | H2 | CO | CH3OH |
濃度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比較此時正、逆反應速率的大小:v正_______v逆 (填“>”、“<”或“=”);若其他條件不變,在T2℃反應10min后達到平衡,c(H2)=0.4 mol·L-1,則該時間內反應速率:
v(CH3OH) =__________;
(4)金屬氧化物被一氧化碳還原生成金屬單質和二氧化碳。下圖是四種金屬氧化物被一氧化碳還原時lg[c(CO)/c(CO2)]與溫度(t)的關系曲線圖。800℃時,其中最易被還原的金屬氧化物是____(填化學式),該反應的平衡常數數值(K)等于____________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com