
�ϳɰ����g(sh��)�Ą�(chu��ng)���_�����˹��̵�����Ҫ;�������о��������_����Փָ��(d��o)���ϳɰ�����(y��ng)��ƽ�ⳣ��(sh��)Kֵ�͜ضȵ��P(gu��n)ϵ���£�
| �� �ȣ��棩 | 360 | 440 | 520 |
| Kֵ | 0��036 | 0��010 | 0��0038 |
 CO(g) + 3H2(g) �@ȡ����֪ԓ����(y��ng)�У���(d��ng)��ʼ��Ϛ��е�
CO(g) + 3H2(g) �@ȡ����֪ԓ����(y��ng)�У���(d��ng)��ʼ��Ϛ��е� 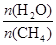 �㶨�r���ضȡ�������ƽ���Ϛ�CH4������Ӱ����D��ʾ��
�㶨�r���ضȡ�������ƽ���Ϛ�CH4������Ӱ����D��ʾ��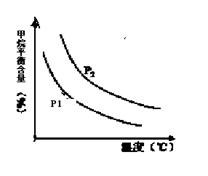
 CO2 (g) + H2(g) �@ȡ��
CO2 (g) + H2(g) �@ȡ����1�����S�ض����ߣ�����(y��ng)��ƽ�ⳣ��(sh��)K�pС ��a��d
��2���� < ������
��3���� 60 % �� 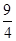 ��2��25 �� c��d
��2��25 �� c��d
����ԇ�}������
��1�����^�씵(sh��)��(j��)�S�ضȵ�����K�pС����֪ԓ����(y��ng)��şᷴ��(y��ng)��������ƽ��rH2���D(zhu��n)���ʣ���׃�l����ƽ�������Ƅӣ����ԼӉ������أ�����N2�ĝ�ȣ��pС����ĝ�ȣ����Դ�a��d���ԡ�
��2�������D���֪���㶨�ضȕr�� P2�c����(y��ng)��CH4��������P1�c�����ɷ���(y��ng)�����c��CH4(g) + H2O (g) CO(g) + 3H2(g)��������w�w�e������Խ��CH4����Խ�ߣ����ԣ�P1<P2���ں㶨�����r���ض�Խ�ߣ�CH4����Խ�ͣ�ԓ����(y��ng)�����ᷴ��(y��ng)��
CO(g) + 3H2(g)��������w�w�e������Խ��CH4����Խ�ߣ����ԣ�P1<P2���ں㶨�����r���ض�Խ�ߣ�CH4����Խ�ͣ�ԓ����(y��ng)�����ᷴ��(y��ng)��
��3����CO����ʼ��Ȟ�0��2 mol��L-1��?c=0��2 mol��L-1-0��08 mol��L-1=0��012 mol��L-1������CO���D(zhu��n)���ʞ�0��012/0��2=0��6�� ԓ����(y��ng)�ĸ����|(zh��)��ƽ���Ȟ�[CO]= [H2O]=0��08 mol��L-1; [CO2] ="[" H2]=0��12 mol��L-1,����(sh��)K=0��12��0��12/0��08��0��08=9/4=2��25��
�ڌ���ԓ����(y��ng)����������(n��i)��������Ϛ��w���ܶ�ʼ�K���S�r�g��׃��ab�e�`��
c����λ�r�g��(n��i)����a mol CO2��ͬ�r����a mol H2���w�F(xi��n)v��=v�棬���_��d����׃ˮ�����CO�ij�ʼ���|(zh��)����֮�ȣ���(d��ng)n (CO) : n (H2O) : n (CO2) : n (H2)��1 : 16 : 6 : 6�r��Q=K�_��ƽ���B(t��i)��
���c�����W(xu��)����(y��ng)���ȵĿ���



| �꼉 | �����n�� | �꼉 | �����n�� |
| ��һ | ��һ���M�n�����]�� | ��һ | ��һ���M�n�����]�� |
| �߶� | �߶����M�n�����]�� | ���� | �������M�n�����]�� |
| ���� | �������M�n�����]�� | ���� | �������M�n�����]�� |
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�����}
����̼ѭ�h(hu��n)����������ĸ߶���ҕ����֪ú������ȿ����cˮ���ⷴ��(y��ng)������CO��H2�����ĺϳɚ⣬�ϳɚ��ЏV����(y��ng)�á�ԇ�ش����І��}��
(1)�ߠt���F��CO���w����Ҫ��;֮һ�����������(y��ng)�飺FeO(s)��CO(g) Fe(s)��CO2(g) ��H��0����֪��1 100 ��r��ԓ����(y��ng)�Ļ��W(xu��)ƽ�ⳣ��(sh��)K=0.263��
Fe(s)��CO2(g) ��H��0����֪��1 100 ��r��ԓ����(y��ng)�Ļ��W(xu��)ƽ�ⳣ��(sh��)K=0.263��
�ٜض����ߣ����W(xu��)ƽ���ƄӺ��_���µ�ƽ�⣬�˕rƽ�ⳣ��(sh��)Kֵ (��������pС����׃��)��
��1 100 ��r�y�øߠt�У�c(CO2)="0.025" mol��L-1��c(CO)="0.1" mol��L-1���t���@�N��r�£�ԓ����(y��ng)�� �M��(����ҡ�)���Д�����(j��)�� ��
(2)Ŀǰ���I(y��)��Ҳ����CO2�����a(ch��n)ȼ�ϼ״������P(gu��n)����(y��ng)�飺CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1���F(xi��n)���w�e��1 L�����]�����У�����1 mol CO2��3 mol H2������(y��ng)�^���Мy��CO2��CH3OH(g)�ĝ���S�r�g��׃����D��ʾ��
CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1���F(xi��n)���w�e��1 L�����]�����У�����1 mol CO2��3 mol H2������(y��ng)�^���Мy��CO2��CH3OH(g)�ĝ���S�r�g��׃����D��ʾ��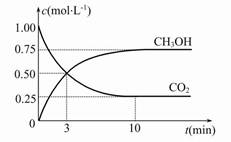
�ُķ���(y��ng)�_ʼ��ƽ�⣬����ƽ������(y��ng)����v(H2)�� ��
�ڷ���(y��ng)�_��ƽ������д�ʩ��ʹ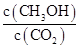 ������� (���̖)��
������� (���̖)��
| A�����ߜض� | B���ٳ���H2 | C���ٳ���CO2 | D����H2O(g)���wϵ�з��x |
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�����}
һ���ض��£���2L���]������NO2��O2�ɰl(f��)�����з���(y��ng)�� 4NO2(g)+O2(g)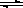 2N2O5(g)+5286 kJ��֪�wϵ��n(NO2)�S�r�g׃�����±���
2N2O5(g)+5286 kJ��֪�wϵ��n(NO2)�S�r�g׃�����±���
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
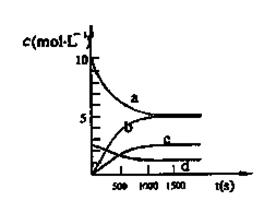
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�����}
���W(xu��)����(y��ng)ԭ���ڿ��к����a(ch��n)���ЏV����(y��ng)�á�
����D�b����ʾ��A��B�е�늘O���Ķ���늘O��C��D��A�ڽ���Na2SO4��Һ�ĞV���l�ϵ��K�A���Դ��a��b�ɘO����A��B�г�MKOH��Һ������KOH��Һ��ˮ���С��Д�K1���]��K2��K3ֱͨ��늡�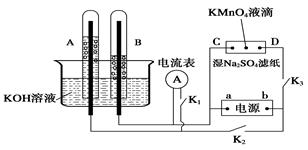
�ش����І��}��
��1�� a���Դ�� �O������A�е�늘O����(y��ng)ʽ��_____��
��2�����Na2SO4�V���l�����^�쵽�ĬF(xi��n)����____________��
��3��늽�һ�Εr�g��A��B�о��К��w����늘O�����˕r�Д�K2��K3���]��K1���l(f��)�F(xi��n)�������ָ��Ƅӣ������˕rB�е�늘O����(y��ng)ʽ�� ��
�״���һ�N��������Դ�����ЏV�����_�l(f��)�͑�(y��ng)��ǰ�������I(y��)��һ��������з���(y��ng)�ϳɼ״���CO(g)��2H2(g)  CH3OH(g) ��H���±����Д�(sh��)��(j��)��ԓ����(y��ng)�ڲ�ͬ�ض��µĻ��W(xu��)ƽ�ⳣ��(sh��)(K)��Ո�ش����І��}��
CH3OH(g) ��H���±����Д�(sh��)��(j��)��ԓ����(y��ng)�ڲ�ͬ�ض��µĻ��W(xu��)ƽ�ⳣ��(sh��)(K)��Ո�ش����І��}��
| �ض� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�����}
������(Si3N4)��һ�N�����մɲ��ϣ�������ʯӢ�c��̿�ڸߜصĵ������У�ͨ�^���·���(y��ng)�Ƶã�3SiO2(s)+6C(s)+ 2N2(g)  Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
��1��ԓ����(y��ng)���������� ��2molN2���ӷ���(y��ng)�D(zhu��n)����Ӕ�(sh��)�� ��
��2��ԓ����(y��ng)��ƽ�ⳣ��(sh��)���_ʽ��K������������ ����
��3����CO���������ʞ�v(CO)��18mol��L-1��min-1���tN2���������ʞ�v(N2)��
��4���_��ƽ���׃ijһ���l��������׃N2��CO������������(y��ng)����v�c�r�gt���P(gu��n)ϵ��D���D��t4�r����ƽ���Ƅӵėl�������� ���D�б�ʾƽ��������CO�ĺ�����ߵ�һ�Εr�g�� ��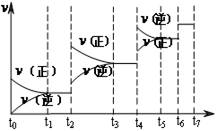
��5����ԓ����(y��ng)��ƽ�ⳣ��(sh��)�� K��729���t��ͬ�ض���1L���]�����У�������SiO2��C�c2mol N2��ַ���(y��ng)���tN2���D(zhu��n)������ (��ʾ��272 = 729)
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�����}
���n����ͨ�^����ᣨH2C2O4����Һ�еμ��������ữ���i������о���Ȍ����W(xu��)����(y��ng)���ʵ�Ӱ푣�Ո�㌑��ԓ����(y��ng)�Ļ��W(xu��)����ʽ ��ԓ����(y��ng)����ʹ��ָʾ����ԭ���� ��
��ijͬ�W(xu��)����(j��)�n�����l�������W(xu��)����(y��ng)���ʵ�Ӱ�ԭ�����O(sh��)Ӌ����������c�c���ᷴ��(y��ng)���P(gu��n)������^�̵Ĕ�(sh��)��(j��)ӛ����£�Ҋ����Ո�Y(ji��)�ϱ�����Ϣ���ش����P(gu��n)���}��
| ��� ��̖ | ����(y��ng)�ض� ���棩 | ���ӷ���(y��ng)�����|(zh��) | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0��1 | 10 | 0��1 | 0 |
| B | 20 | 5 | 0��1 | 10 | 0��1 | 5 |
| C | 20 | 10 | 0��1 | 5 | 0��1 | 5 |
| D | 40 | 5 | 0��1 | 10 | 0��1 | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�����}
ijС�M����H2C2O4��Һ������KMnO4��Һ����(y��ng)��̽�������l�������W(xu��)����(y��ng)���ʵ�Ӱ푡������r���ȷքe��ȡ�ɷN��Һ��Ȼ����ԇ����Ѹ����ʎ��Ͼ����_ʼӋ�r��ͨ�^�y����ɫ����r�g���Д෴��(y��ng)�Ŀ�����ԓС�M�O(sh��)Ӌ�����·�����
| ��̖ | H2C2O4��Һ | ����KMnO4��Һ | �ض� | ||
| ���(mol·L��1) | �w�e(mL) | ���(mol·L��1) | �w�e (mL) | ||
| �� | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| �� | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| �� | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
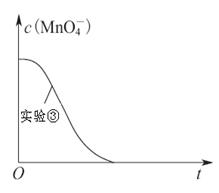
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�����}
��֪����(y��ng)A��g��+B(g) C(g)+D(g)��H��0�ش����І��}��
C(g)+D(g)��H��0�ش����І��}��
��1��ԓ����(y��ng)��________����(y��ng)������ᡱ�şᡱ��
��2����(d��ng)����(y��ng)�_��ƽ��r�����ߜضȣ�A���D(zhu��n)����________��������pС����׃������ԭ����________________________________________��
��3������(y��ng)�wϵ�м��������������(y��ng)���Ƿ���Ӱ푣�________��ԭ����_________________________________________________��
��4������(y��ng)�wϵ�м������������(y��ng)����________��������pС����׃����������(y��ng)�Ļ��________��������pС����׃������
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�����}
�״�����Ҫ�Ļ��W(xu��)���I(y��)���A(ch��)ԭ�Ϻ��坍Һ�wȼ�ϡ����I(y��)�Ͽ�����CO��CO2�����a(ch��n)ȼ�ϼ״�����֪�״��Ƃ�����P(gu��n)���W(xu��)����(y��ng)�Լ��ڲ�ͬ�ض��µĻ��W(xu��)����(y��ng)ƽ�ⳣ��(sh��)���±���ʾ��
| ���W(xu��)����(y��ng) | ƽ�ⳣ��(sh��) | �ضȡ� | |
| 500 | 800 | ||
��2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
��3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
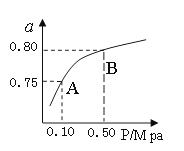


�鿴�𰸺ͽ���>>
���H�W(xu��)У��(y��u)�x - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com