
【題目】根據所學知識填空.
(1)在25℃條件下將pH=11的氨水稀釋100倍后溶液的pH為(填序號) .
A.9
B.13
C.11~13之間
D.9~11之間
(2)25℃時,向0.1mol/L的氨水中加入少量氯化銨固體,當固體溶解后,測得溶液pH減小,主要原因是(填序號) .
A.氨水與氯化銨發生化學反應
B.氯化銨溶液水解顯酸性,增加了c(H+)
C.氯化銨溶于水,電離出大量銨離子,抑制了氨水的電離,使c(OH﹣)減小
(3)室溫下,如果將0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假設無損失),
①和兩種粒子的物質的量之和等于0.1mol.
②和兩種粒子的物質的量之和比OH﹣多0.05mol.
(4)已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四種離子,某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:
A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一種溶質,該溶質的名稱是 , 上述離子濃度大小順序關系中正確的是(選填序號) .
②若上述關系中C是正確的,則溶液中溶質的化學式是 .
③若該溶液中由體積相等的稀鹽酸和氨水混合而成,且恰好呈中性,則混合前c(HCl)c(NH3H2O)(填“>”、“<”、或“=).
【答案】
(1)D
(2)C
(3)NH3?H2O;NH4+;NH4+;H+
(4)氯化銨;A;NH4Cl和HCl;<
【解析】解:(1.)一水合氨為弱電解質,存在電離平衡,稀釋后一水合氨的電離程度增大,溶液中氫氧根離子的物質的量增大,所以將pH=11的氨水稀釋100倍后,稀釋后的溶液中氫氧根離子濃度大于原來的 ![]() ,溶液的pH應該9﹣11之間,
,溶液的pH應該9﹣11之間,
所以答案是:D;
(2.)一水合氨是弱電解質,溶液中存在電離平衡,向溶液中加入氯化銨,銨根離子濃度增大,抑制一水合氨電離,導致溶液中氫氧根離子濃度減小,溶液的pH減小,
A.氨水與氯化銨不發生化學反應,故A錯誤;
B.氯化銨溶液水解顯酸性,但銨根離子濃度遠遠大于氫離子濃度,所以銨根離子抑制一水合氨電離為主,氫離子濃度減小,故B錯誤;
C.氯化銨溶于水,電離出大量銨根離子,抑制了氨水的電離,使c(OH﹣)減小,故C正確;故選:C;
(3.)①根據N原子守恒可知,溶液中NH3H2O和NH4+兩種粒子的物質的量之和等于0.1mol,所以答案是:NH3H2O;NH4+;②根據電荷守恒式c(NH4+)+c(H+)+c(Na+)=c(OH﹣)+c(Cl﹣),則c(NH4+)+c(H+)﹣c(OH﹣)=c(Cl﹣)﹣c(Na+)=0.1mol﹣0.05mol,所以答案是:NH4+;H+
(4.)①水中含有氫離子和氫氧根離子,若溶液中只溶解了一種溶質,該溶質是NH4Cl,氯化銨為強酸弱堿鹽,其溶液呈酸性,所以c(H+)>c(OH﹣),溶液中存在電荷守恒,根據電荷守恒得c(Cl﹣)>c(NH4+),鹽類水解較微弱,所以離子濃度大小順序是c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣),所以答案是:氯化銨;A;②若上述關系中c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)是正確的,溶液呈酸性,則溶液中的溶質為氯化銨和HCl,所以答案是:NH4Cl和HCl;③若該溶液中由體積相等的稀鹽酸和氨水混合而成,且恰好呈中性,氯化銨溶液呈堿性,要使氨水和稀鹽酸混合溶液呈中性,則氨水物質的量應該稍微大些,因為二者體積相等,所以c(HCl)<c(NH3H2O),所以答案是:<.


科目:高中化學 來源: 題型:
【題目】已知N2、CO2的混合氣體的質量共9.6克,標準狀況下,體積為6.72L,則該混合氣體中N2和CO2的體積比為
A.3:1B.1:3C.2:3D.1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應可用離子方程式“H++OH-=H2O”表示的是
A. 稀硫酸與澄清石灰水溶液混合
B. 濃硫酸與燒堿溶液混合
C. 濃硝酸與氫氧化鉀溶液混合
D. 濃鹽酸與石灰乳溶液混合
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關晶體的敘述中,不正確的是( )
A.金剛石的網狀結構中,由共價鍵形成的碳原子環,其中最小的環上有6個碳原子
B.在氯化鈉晶體中,每個Na+或Cl﹣的周圍緊鄰6個Cl﹣或6個Na+
C.干冰晶體熔化時,1mol干冰要斷裂2mol碳氧雙鍵
D.在氯化銫晶體中,每個Cs+周圍緊鄰8個Cl﹣ , 每個Cl﹣周圍也緊鄰8個Cs+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對實驗操作及結論的描述不正確的是( )
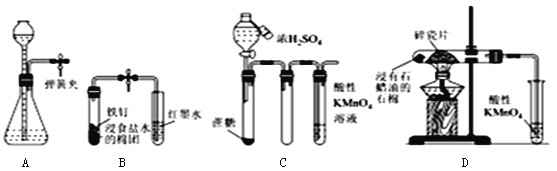
A. 夾緊彈簧夾,由長頸漏斗加水至產生液面差,一段時間后液面差不變,說明氣密性良好
B. 打開彈簧夾,紅墨水倒吸入導氣管中,說明鐵釘發生了吸氧腐蝕
C. 滴加濃硫酸后,高錳酸鉀溶液褪色,說明濃硫酸使蔗糖脫水的同時還產生了二氧化硫
D. 加熱片刻后高錳酸鉀溶液褪色,說明石蠟油分解產生了乙烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A是生產生活中用量最大的金屬,B為淡黃色粉末。在常溫下C為無色液體,E、G、H、I、J為氣體,其中H為黃綠色,其它為無色。J能使濕潤的紅色石蕊試紙變藍(圖中部分產物已略去)。
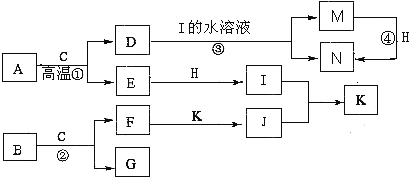
請填寫下列空白
(1)寫出化學式:D ,K 。
(2)寫出②的離子方程式 。
(3)反應④不屬于下列何種反應類型 (填字母序號)。
A.化合反應 B.氧化還原反應 C.離子反應 D.置換反應
(4)若要確定③反應后所得溶液中含有M物質,所選試劑為 (填序號)。
A.KSCN溶液和氯水 B.鐵粉和KSCN
C.濃氨水 D.酸性高錳酸鉀溶液
(5)將F加入到M的溶液里并露置在空氣中,可以觀察到整個過程的現象是:
。
(6)常溫下,H與過量的J反應產生濃厚的白煙,另一生成物是空氣的主要成分之一,請寫出該反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質X的結構式如圖所示,下列關于物質X的說法正確的是( ) 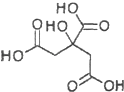
A.X分子式為C6H6O7
B.X可發生水解反應、加成反應、氧化反應
C.X分子內所有碳原子均在同一平面內
D.1mol物質X與足量的Na反應可產生2mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的有機產物,肯定是一種的是( )
A.異戊二烯( ![]() )與等物質的量的Br2發生加成反應
)與等物質的量的Br2發生加成反應
B.2﹣氯丁烷( ![]() )與NaOH溶液共熱發生反應
)與NaOH溶液共熱發生反應
C.甲苯在一定條件下發生硝化生成一硝基甲苯的反應
D.等物質的量的甲烷和氯氣的混和氣體長時間光照后的產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘被稱為“智力元素”,科學合理地補充碘可防止碘缺乏病.碘酸鉀(KIO3)是國家規定的食鹽加碘劑,它的晶體為白色,可溶于水.碘酸鉀在酸性介質中與過氧化氫或碘化物作用均生成單質碘.以碘為原料,通過電解制備碘酸鉀的實驗裝置如圖所示. 
請回答下列問題:
(1)碘是物質,實驗室常用方法來分離提純含有少量雜質的固體碘.
(2)寫出碘酸鉀在酸性介質中與過氧化氫反應的離子方程式:
(3)電解前,先將一定量的精制碘溶于過量氫氧化鉀溶液,溶解時發生反應:3I2+6KOH=5KI+KIO3+3H2O,將該溶液加入陽極區.另將氫氧化鉀溶液加入陰極區,電解槽用水冷卻.圖中的序號3應為離子交換膜(填“陽”或“陰”);電解時,陽極上發生反應的電極反應式為 .
(4)教材中利用KI與空氣的反應來探究反應速率與溫度的關系,現有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,則實驗時這幾種試劑的加入順序為:KI溶液、、;反應的離子方程式為 .
(5)已知KI+I2KI3 , 將I2溶于KI溶液,在低溫條件下,可制得KI3H2O.該物質作為食鹽加碘劑是否合適?(填“是”或“否”),并說明理由 . 為了提高加碘鹽(添加KI)的穩定性,可加穩定劑減少碘的損失.下列物質中有可能作為穩定劑的是 . A.Na2S2O3B.AlCl3C.Na2CO3D.NaNO2 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com