
【題目】2:326.26.26 聯(lián)合國將2011年定為“國際化學年”,主題是“化學,人類的生活,人類的未來”,以鼓勵青年人熱愛化學。學習化學應該明白“從生活中來,到生活中去”的道理。

請?zhí)羁眨?/span>
(1)成人每天應從食物中攝取的幾種元素的質(zhì)量分別為: Mg 300 mg、Ca 800 mg、Fe 14 mg、Cu 1.6 mg,這些元素的物質(zhì)的量之比為_________。
(2)病人輸液用的葡萄糖注射液是葡萄糖(化學式C6H12O6)的水溶液,其標簽上的部分內(nèi)容如右圖所示。利用標簽所提供的信息,計算出該注射液中葡萄糖的物質(zhì)的量濃度為__________。
(3)SO2有毒,但葡萄酒里都含有微量SO2,起保鮮、殺菌和抗氧化作用,抗氧化作用利用了SO2的_______性。“硅膠”常用作實驗室和袋裝食品、瓶裝藥品等的干燥劑,也可以用作_______的載體。實驗室可用________溶液來鑒別某未知液是蘇打水還是水玻璃。
 導學全程練創(chuàng)優(yōu)訓練系列答案
導學全程練創(chuàng)優(yōu)訓練系列答案科目:高中化學 來源: 題型:
【題目】已知蛋白質(zhì)含有C、H、O、N等元素。下列關(guān)于自然界中氮循環(huán)的說法錯誤的是
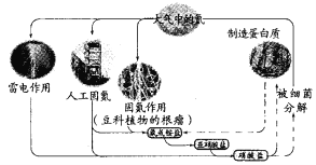
A. 含氮無機物和含氮有機物可相互轉(zhuǎn)化
B. 碳、氫、氧三種元素也可能參與了氮循環(huán)
C. 銨鹽轉(zhuǎn)化為硝酸鹽,發(fā)生了還原反應
D. 目前人工固氮的反應為N2+3H2![]() 2NH3
2NH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組同學對電化學原理進行了一系列探究活動。
(1)如圖為某實驗小組設計的原電池裝置,反應前,電極質(zhì)量相等,一段時間后,兩電極質(zhì)量相差12g,導線中通過_______mol電子。
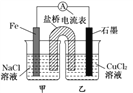
(2)其他條件不變,若將CuCl2溶液換為NH4Cl溶液,石墨電極反應式為____________________,用吸管吸出鐵片附近溶液少許置于試管中,向其中滴加少量新制飽和氯水,寫出發(fā)生反應的離子方程式:_____________________,然后滴加幾滴硫氰化鉀溶液,溶液變紅,繼續(xù)滴加過量新制氯水,顏色褪去,同學們對此做了多種假設,某同學的假設是,“溶液中的十3價鐵被氧化為更高的價態(tài)。”如果+3價鐵被氧化為FeO42-,試寫出該反應的離子方程式:________________________________。
(3)如圖其他條件不變,若將鹽橋換成彎銅導線與石墨相連成n型,如圖所示。一段時間后,在甲裝置銅絲附近滴加酚酞溶液,現(xiàn)象是_______________,電極反應為________________;乙裝置中石墨(1)為_______(填“正”“負”“陰”或“陽”),乙裝置中與銅絲相連石墨電極上發(fā)生的反應式為______________________。
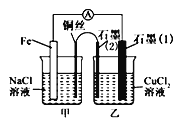
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaH與水反應化學方程式為NaH+H2O=NaOH+H2↑.在該反應中H2O是( )
A.是氧化劑
B.是還原劑
C.既是氧化劑又是還原劑
D.既不是氧化劑又不是還原劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A為常見的金屬單質(zhì),根據(jù)如圖所示的轉(zhuǎn)化關(guān)系回答下列問題。
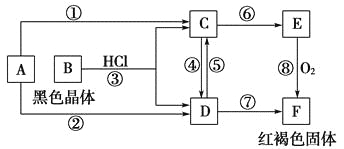
(1)確定A、B、C、D、E、F的化學式:
A為________,B為________,C為________。
D為________,E為________,F為________。
(2)寫出⑧的化學方程式及④、⑤的離子方程式:___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關(guān)于熱化學方程式的說法正確的是
A. H2的燃燒熱為285.8 kJ·mol1,則表示H2燃燒的熱化學方程式可表示為:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和熱為57.3 kJ·mol1,則NaOH與醋酸反應的中和熱可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金剛石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,則C(s,金剛石)
CO2(g) ΔH=393.5 kJ·mol1,則C(s,金剛石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃燒生成CO2和液態(tài)水放出890.4 kJ的熱量,則該反應中轉(zhuǎn)移1 mol電子時放出的熱量為222.6 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列氧化還原反應中,水既不做氧化劑又不做還原劑的是( )
A. CaO + H2O===Ca(OH)2 B. C+H2O(g)![]() CO+H2
CO+H2
C. 2F2 + 2H2O===4HF + O2 D. 2Na2O2 +2H2O===4NaOH + O2 ↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據(jù)題目要求回答下列問題:
(1)某同學查閱資料并設計如下實驗。
資料:AgSCN是白色沉淀,相同溫度下,溶解度AgSCN>AgI。
操作步驟 | 現(xiàn)象 |
步驟1:向2 mL 0.005 mol/L AgNO3溶液中加入2 mL 0.005 mol/L KSCN溶液,靜置 | 出現(xiàn)白色沉淀 |
步驟2:取1 mL上層清液于試管中,滴加1滴2 mol/L Fe(NO3)3溶液 | 溶液變?yōu)榧t色 |
步驟3:向步驟2的溶液中繼續(xù)加入5滴3 mol/L AgNO3溶液 | 溶液渾濁、紅色變淺 |
步驟4:向步驟1余下的濁液中加入5滴3 mol/L KI溶液 | 出現(xiàn)黃色沉淀 |
① 步驟3實驗目的是_____________________________。
② 用化學平衡原理解釋步驟4中的實驗現(xiàn)象:___________________________。
(2)已知:
NH4Cl(s) = NH3(g) + HCl(g) ΔH = +163.9 kJmol-1
HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g) ΔH = -31.9 kJmol-1
①寫出氯化銨和甲醇反應的熱化學方程式____________________________,該反應在一定條件下能自發(fā)進行的原因是___________________________。
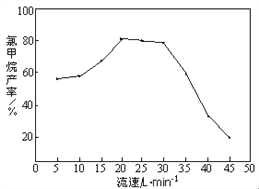
②由下圖知,HCl和CH3OH的混合氣體通過催化劑時的最佳流速在20 Lmin-1~30 Lmin-1之間。流速過快,會導致氯甲烷產(chǎn)率下降,原因是_________________________。流速過慢,會使副產(chǎn)物二甲醚增多,其反應為2CH3OH → CH3OCH3 + H2O,生產(chǎn)中常通入適量的水蒸氣,該操作對制備CH3Cl的影響是___________________________。
(3)某高能鋰離子電池充電時,總反應方程式為LiMn2O4=Li1-xMn2O4+xLi。則充電時陽極的電極反應方程式為______________________________________________。若電池的化學能轉(zhuǎn)化為電能時的能量轉(zhuǎn)化率為90%,則當消耗14 g鋰時,電路中轉(zhuǎn)移的電子數(shù)目為__________NA。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com