
【題目】①某NaCl樣品中可能含有SO42﹣ , CO32﹣ , 為檢驗雜質離子的存在,采取如下實驗步驟:
樣品 ![]()
![]() 無明顯現象
無明顯現象 ![]() 無明顯現象.則加入的試劑A為 , B為(填化學式),該現象證明樣品中不含有 .
無明顯現象.則加入的試劑A為 , B為(填化學式),該現象證明樣品中不含有 .
②在后續實驗中需要使用450mL0.5molL﹣1NaCl溶液,為配制該濃度NaCl溶液進行實驗,需用托盤天平稱取NaClg.
③配制NaCl溶液時,若出現下列操作,會使配制濃度偏高的是
A.稱量時NaCl已潮解
B.天平砝碼已銹蝕
C.定容時俯視刻度線
D.定容搖勻后液面下降,又加水至刻度.
【答案】鹽酸;氯化鋇;CO32﹣、SO42﹣;14.6;BC
【解析】解:①取樣品溶解,加入足量稀鹽酸,無氣泡產生,說明樣品中不含碳酸根,再加入氯化鋇溶液,無白色沉淀產生,說明溶液中不含硫酸根,故答案為:鹽酸;氯化鋇;CO32﹣、SO42﹣;②容量瓶的規格沒有450mL,應選500mL配制,則需氯化鈉的物質的量為:n=cV=0.50mol/L×0.5L=0.25mol,氯化鈉的質量為:m=nM=0.25mol×58.5g/mol=14.625g,托盤天平應保留1位小數,氯化鈉的質量為14.6g,
故答案為:14.6;③A.稱量時NaCl已潮解,溶質偏少,濃度偏低,故A錯誤;
B.天平砝碼生銹,所稱溶質氯化鈉質量偏大,濃度偏高,故B正確;
C.定容時,俯視讀取刻度,導致溶液體積偏小,溶液濃度偏高,故C正確;
D.定容搖勻后液面下降,是正常現象,又加水至刻度,導致溶液體積偏大,溶液濃度偏低,故D錯誤;
故答案為:BC.
①用稀鹽酸檢驗碳酸根的存在,再用氯化鋇檢驗硫酸根的存在;②容量瓶的規格沒有450mL,應選500mL配制,依據n=cV計算物質的量,再計算出質量;③分析操作對溶質的物質的量n和溶液的體積V,依據c= ![]() 進行誤差分析,凡是使n偏大或者使V偏小的操作,溶液濃度偏高,凡是使n偏小或者V偏大的操作,溶液濃度偏低.
進行誤差分析,凡是使n偏大或者使V偏小的操作,溶液濃度偏高,凡是使n偏小或者V偏大的操作,溶液濃度偏低.


科目:高中化學 來源: 題型:
【題目】為了實現“將全球溫度上升幅度控制在2℃以內”的目標,科學家正在研究溫室氣體CO2的轉化和利用。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四種無機碳形式存在,分別為CO2、H2CO3、CO32-和_________(填離子符號)。
②在海洋中,可通過如圖所示的途徑來固碳。則發生光合作用時,CO2與H2O反應生成(CH2O)x和O2的化學方程式為__________________。

(2)有科學家提出可利用FeO來吸收CO2,已知:
C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
則6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
(3)以CO2為原料可制備甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),向一恒容密閉容器中充入1moCO2(g)和3molH2(g),測得CO2(g)和CH3OH(g)的濃度隨時間的變化如圖所示。
CH3OH(g)+H2O(g),向一恒容密閉容器中充入1moCO2(g)和3molH2(g),測得CO2(g)和CH3OH(g)的濃度隨時間的變化如圖所示。
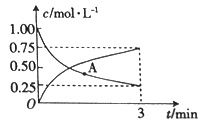
①若A點的正反應速率用v正(CO2)來表示,A點的逆反應速率用v逆(CO2)來表示,則v正(CO2)_______(填“>”“ <”或“=”)v逆(CO2)。
②0~3min內,氫氣的平均反應速率v(H2)_______________。
(4)在一定條件下,二氧化碳轉化為甲烷:CO2(g)+4H2(g)![]() CH4(g)+2 H2O(g),△H。向一密閉容積正充入一定量的CO2和H2,在300℃時發生上述反應,達到平衡時測得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。則該溫度下上述反應的平衡常數K= ________。若200℃時該反應的平衡常數K=64.8,則該反應的△H_____(填“>’’或“<”)O。
CH4(g)+2 H2O(g),△H。向一密閉容積正充入一定量的CO2和H2,在300℃時發生上述反應,達到平衡時測得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。則該溫度下上述反應的平衡常數K= ________。若200℃時該反應的平衡常數K=64.8,則該反應的△H_____(填“>’’或“<”)O。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(多選)下列說法正確的是( )
A.瓦斯中甲烷和氧氣的質量比為1:4時極易爆炸,此時甲烷與氧氣的體積比為1:2
B.欲配制1.00 L1.00 molL﹣1的NaCl溶液,可將58.5 g NaCl溶于1.00 L水中
C.22.4LN2和H2的混合氣體中含NA個原子
D.3mol單質Fe完全轉變為Fe3O4 , 得到8NA個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生設計了如圖實驗,以下說法錯誤的是( ) 
A.該同學的實驗目的是分離氯化鈉、氯化鈣
B.上圖括號內的操作步驟均為加熱蒸發
C.按此實驗方案可得到較純凈的NaCl固體
D.按此實驗方案可得到較純凈的CaCl2固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關描述正確的是
A. Li、B、Be原子最外層電子數逐漸增多
B. 熔點:Cs低于K; 沸點:Br2高于Cl2
C. 根據周期律可推測硫酸銣、硫酸銫都難溶于水
D. Li、Na、K、Rb的密度都逐漸增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下,560mL某氣體A的質量為0.75g,則其摩爾質量為;已知該氣體在水中的溶解度為448(氣體溶解度指該氣體在壓強為101kPa,0℃時,溶解在1體積水里達到飽和狀態時的氣體的體積),則得到的飽和溶液中溶質A的質量分數為(A不與水反應),若測得該溶液密度為1.24g/cm3 , 則該溶液的物質的量濃度為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在相同的溫度和壓強下,4個容器中分別裝有4種氣體.已知各容器中的氣體和容器的容積分別是a.CO2 , 100mL;b.O2 , 200mL;c.N2 , 400mL;d.CH4 , 600mL,則4個容器中氣體的質量由大到小的順序是( )
A.a>b>c>d
B.b>a>d>c
C.c>d>b>a
D.d>c>a>b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,將等量的氣體分別通入起始體積相同的密閉容器I和Ⅱ中(如圖),使其發生反應,t0時容器I中達到化學平衡,X、Y、Z的物質的量的變化如圖所示。則下列有關推斷正確的是( )

A. 該反應的化學方程式為:3X +2Y![]() 3Z
3Z
B. 若兩容器中均達到平衡時,兩容器的體積V(I)<V(Ⅱ),則容器II達到平衡所需時間小于t0
C. 若兩容器中均達到平衡時,兩容器中Z的物質的量分數相同,則Y為固態或液態
D. 若達平衡后,對容器Ⅱ升高溫度時,其體積減小,說明Z發生的反應為吸熱反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com