
【題目】下列有機物在酸性催化條件下發生水解反應, 生成兩種不同的有機物, 且這兩種有機物的相對分子質量相等, 該有機物可能是
A.蔗糖B.麥芽糖C.乙酸乙酯D.甲酸乙酯
科目:高中化學 來源: 題型:
【題目】原電池原理的發現是儲能和供能技術的巨大進步,是化學對人類的項重大貢獻。
(1)某課外實驗小組欲探究鋁和銅的金屬性(原子失電子能力)強弱,同學們提出了如下實驗方案:
A.比較鋁和銅的硬度和熔點
B.比較二者在稀硫酸中的表現
C.用鋁片、銅片、硫酸鋁溶液、硫酸銅溶液,比較二者的活動性
D.分別做鋁片、銅片與NaOH溶液反應的實驗
E.將鋁片、銅片用導線連接后共同投入稀鹽酸中接入電流計,觀察電流方向
上述方案中能達到實驗目的的是_________________。
(2)現有如下兩個反應:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑。上述反應中能設計成原電池的是________ (填字母代號),作負極的物質發生了________反應(填“氧化”或“還原”)。
(3)將純鋅片和純銅片按如圖所示方式插入100mL相同濃度的稀硫酸一段時間,回答下列問題:

①下列說法正確的是________ (填字母代號)。
A.甲、乙均為化學能轉變為電能的裝置 B.乙中銅片上沒有明顯變化
C.甲中銅片質量減少、乙中鋅片質量減少 D.兩燒杯中溶液的酸性均減弱
②在相同時間內,兩燒杯中產生氣泡的速度:甲________乙(填“>”、“<”或“=”)。原因是________。
③當甲中產生1.12L(標準狀況)氣體時,將鋅、銅片取出,再將燒杯中的溶液稀釋至1L,測得溶液中c(H+)=0.1mol/L(設反應前后溶液體積不變)。試確定原稀硫酸的物質的量濃度為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】學習中經常應用類推法。下列表格左邊正確,類推法應用于右邊也正確的是( )
A | 向FeCl2溶液中滴入氯水 2Fe2++Cl2=2Fe3++2Cl— | 向FeCl2溶液中滴入碘水 2Fe2++I2=2Fe3++2I— |
B | 向澄清石灰水中通入少量CO2氣體 Ca2++2OH—+CO2 =CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 氣體 Ca2++2OH—+SO2=CaSO3↓+H2O |
C | 向Na2CO3溶液中滴入稀HNO3
| 向Na2SO3溶液中滴入稀HNO3
|
D | 鋅粒放入硫酸亞鐵溶液中 Zn+Fe2+=Zn2++Fe | 鈉投入硫酸銅溶液中 2Na+Cu2+=2Na++Cu |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在恒容密閉容器中發生如下反應:2A(g)+B(g)![]() 3C(g),若反應開始時充入2 mol A和2 mol B,達平衡后A的體積分數為a%。其他條件不變時,若按下列四種配比作為起始物質,平衡后A的體積分數大于a%的是
3C(g),若反應開始時充入2 mol A和2 mol B,達平衡后A的體積分數為a%。其他條件不變時,若按下列四種配比作為起始物質,平衡后A的體積分數大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不參加反應)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“酸雨”的形成主要是由于( )
A. 森林遭亂砍濫伐,破壞了生態平衡 B. 工業上大量燃燒含硫燃料
C. 大氣中二氧化碳的含量增多 D. 汽車排出大量尾氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列操作能達到預期目的的是
A.將苯和溴水混合后加入鐵粉制取溴苯B.用金屬鈉區分乙醇和乙醚
C.用酸性高錳酸鉀溶液除去乙炔中含有的 H2SD.將敞口久置的電石與飽和食鹽水混合制乙炔
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有A、B、X、Y、Z五種短周期元素,原子序數依次增大。它們的性質或原子結構如下表:
元素 | 性質或原子結構 |
A | 原子核內只有一個質子 |
B | 單質是空氣中含量最多的氣體 |
X | 原子的最外層電子數是次外層電子數的3倍 |
Y | 短周期元素中原子半徑最大的元素 |
Z | 最高正化合價與最低負化合價的代數和為6 |
請回答:
①X元素在元素周期表中的位置是______________;
②Z單質通入Y的最高價氧化物對應水化物的溶液中,可以得到漂白液,相應反應的離子方程式為___________________________________________________;
③化合物甲由A和B兩種元素組成且質量比為3:14,甲與X單質在催化劑、加熱條件下發生的反應是工業上制取硝酸的基礎,寫出該反應的化學方程式____________。
(2)短周期元素X、Y、Z在周期表中的位置關系如圖所示
X | ||
Y | ||
Z |
①X元素單質的化學式是_________,若X核內中子數與質子數相等,則X單質的摩爾質量為________;
②Y單質的電子式是_________;Z與鈣形成的化合物的電子式是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學校化學學習小組為探究二氧化氮的性質,按下圖所示裝置進行實驗。

(1)裝置甲中發生反應的化學方程式為________________________。
(2)裝置丙中的試管內發生反應的離子方程式為:_______________________。
(3)為了探究NO的還原性,可以在裝置丁的導氣管C中通入一種氣體,通入的這種氣體的名稱是________。
(4)取下裝置丙中的試管D,在其中滴加FeSO4溶液,溶液變為________色,為了證明鐵元素在該反應中的產物,可以再在溶液中滴加NH4SCN溶液,用離子方程式表示檢驗原理___________。
(5)硝酸廠常用催化還原方法處理尾氣。CH4在催化條件下可以將NO2還原為N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
則CH4還原NO2生成水蒸氣和氮氣的熱化學方程式是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)如圖1所示是NO2和CO反應生成CO2和NO過程中的能量變化示意圖,說明這個反應是 _______(填“吸熱”或“放熱”)反應,斷鍵吸收的能量為___________ (填E1或E2)
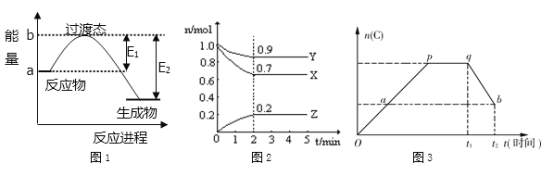
(2)某溫度時,在一個2 L的密閉容器中,X、Y、Z三種物質物質的量隨時間的變化曲線如圖2所示。根據圖中數據,試填寫下列空白:
①該反應在_____________min時達到平衡狀態;
②該反應的化學方程式為:_________________________________________;
(3)一定溫度下,對于反應2A(g) + B(g) ![]() 2C(g)在反應過程中C的物質的量n(C)隨著時間變化關系如圖3所示,現從t1時間開始對反應體系升高溫度,n(C)的變化如圖qb所示。則:①p點時反應的v正_____v逆(填“>”、“<”或“=”);
2C(g)在反應過程中C的物質的量n(C)隨著時間變化關系如圖3所示,現從t1時間開始對反應體系升高溫度,n(C)的變化如圖qb所示。則:①p點時反應的v正_____v逆(填“>”、“<”或“=”);
②a,b兩點的正反應速率va________vb(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com