Ⅰ.為探究CO
2和NaOH確實發生了化學反應,某實驗小組的同學設計了下列4種實驗裝置,請回答下列問題:
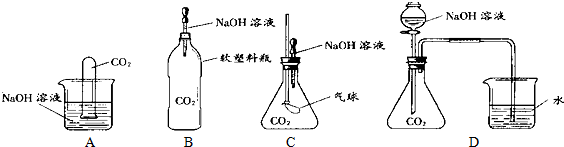
(1)選擇實驗裝置C,簡述出現的實驗現象以及產生該實驗現象的原因:
,
.
(2)某同學質疑上述所有實驗設計,該同學質疑的依據是
.
(3)實驗D向錐形瓶中滴入過量的濃NaOH溶液后,滴加
溶液,若出現白色沉淀,說明原實驗中生成了CO
32-.
Ⅱ.(4)向100mL2mol/L的NaOH 溶液中通入一定量CO
2,充分反應后將溶液蒸發結晶,使溶質完全析出,得到白色固體(不考慮結晶水).試設計實驗確認該白色固體的成分.
①提出合理假設.
假設1:NaHCO
3和Na
2CO
3; 假設2:只有Na
2CO
3;
假設3:只有NaHCO
3; 假設4:
.
②基于假設1,設計實驗方案證明固體中含有NaHCO
3.(限選實驗試劑及儀器:1moL?L
-1HCl溶液、0.5moL?L
-1BaCl
2溶液、1mol?L
-1 Ba(OH)
2溶液、甲基橙試液、酚酞試液、蒸餾水、試管、過濾裝置.
(5)實驗小組的同學用鹽酸滴定的方法測定白色固體(NaHCO
3和Na
2CO
3)中NaHCO
3的物質的量分數.若用酚酞作指示劑,逐滴加入鹽酸至溶液由紅色變無色時Na
2CO
3完全轉化為NaHCO
3.將上述白色固體溶于水配得250ml溶液,取25.00mL 于錐形瓶中用酚酞作指示劑滴定至溶液由紅色變無色時消耗0.2000moL?L
-1HCl溶液25.00mL.白色固體中NaHCO
3的物質的量分數=
.




 名校通行證有效作業系列答案
名校通行證有效作業系列答案
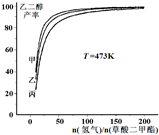 (氫氣)/n(草酸二甲酯)]和壓強的變化關系,其中三條曲線分別表示體系壓強為1.5MPa、2.5MPa、3.5MPa的情況,則曲線甲對應的壓強是P(甲)=
(氫氣)/n(草酸二甲酯)]和壓強的變化關系,其中三條曲線分別表示體系壓強為1.5MPa、2.5MPa、3.5MPa的情況,則曲線甲對應的壓強是P(甲)=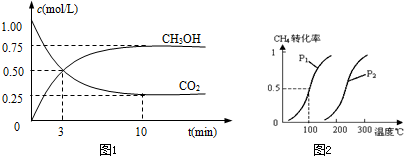
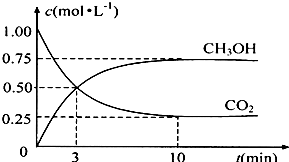
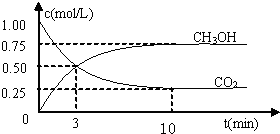
 法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g)
法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如右上圖表示該反應進行過程中能量(單位為kJ?mol-1)的變化.
CH3OH(g)+H2O(g),如右上圖表示該反應進行過程中能量(單位為kJ?mol-1)的變化.
 隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普遍關注
隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普遍關注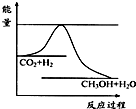 溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引起了各國的普遍重視.目前工業上有一種方法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如圖表示該反應進行過程中能量(單位為kJ?mol-1)的變化.
溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引起了各國的普遍重視.目前工業上有一種方法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如圖表示該反應進行過程中能量(單位為kJ?mol-1)的變化.