
【題目】下列反應屬于吸熱反應的是( )
A.C6H12O6(葡萄糖)+6O2═6CO2+6H2O
B.CH3COOH+KOH═CH3COOK+H2O
C.所有高溫條件下發生的反應
D.C+CO2 ![]() 2CO
2CO
 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案 同步練習西南大學出版社系列答案
同步練習西南大學出版社系列答案科目:高中化學 來源: 題型:
【題目】以電石渣[主要成分為Ca(OH)2和CaCO3]為原料制備KClO3的流程如圖1: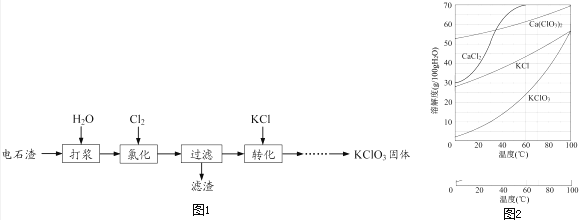
(1)氯化過程控制電石渣過量,在75℃左右進行.氯化時存在Cl2與Ca(OH)2作用生成Ca(ClO)2的反應,Ca(ClO)2進一步轉化為Ca(ClO3)2 , 少量Ca(ClO)2 分解為CaCl2和O2 .
①生成Ca(ClO)2的化學方程式為 .
②提高Cl2轉化為Ca(ClO3)2的轉化率的可行措施有(填序號).
A.適當減緩通入Cl2速率 B.充分攪拌漿料 C.加水使Ca(OH)2完全溶解
(2)氯化過程中Cl2 轉化為Ca(ClO3)2的總反應方程式為:
6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O
氯化完成后過濾.
①濾渣的主要成分為(填化學式).
②濾液中Ca(ClO3)2與CaCl2的物質的量之比n[Ca(ClO3)2]:n[CaCl2]1:5(填“>”、“<”或“=”).
(3)向濾液中加入稍過量KCl固體可將Ca(ClO3)2轉化為KClO3 , 若溶液中KClO3的含量為100gL﹣1 , 從該溶液中盡可能多地析出KClO3固體的方法是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,關于溶液的稀釋說法正確的是( )
A.將1 L 0.1molL﹣1的Ba(OH)2溶液加水稀釋為2L,pH=13
B.pH=3的醋酸溶液加水稀釋100倍,pH=5
C.pH=4的H2SO4加水稀釋100倍,溶液中由水電離產生的[H+]=1×10﹣6molL﹣1
D.pH=8的NaOH溶液加水稀釋100倍,其pH=6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某試液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干種離子,離子濃度均為0.1molL﹣1 . 某同學進行了如圖實驗: 
(1)根據實驗現象判斷,濾液X中大量存在的陽離子有;
(2)沉淀A的化學式;沉淀B的化學式;
(3)沉淀C的成分(填“能”或“不能”)確定.若能確定,寫出化學式;若不能,說明理由 .
(4)該溶液中一定存在的離子是;一定不存在的離子是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A元素原子的L層比B元素原子的L層少3個電子,B元素原子核外電子數比A元素原子核外電子總數多5個,則A,B兩元素形成的化合物可表示為( )
A.BA2
B.BA3
C.A3B2
D.B3A2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖是中學教材中元素周期表的一部分,其中標出A~Q14種元素,試回答下列問題: 
(1)在上表所列出的短周期元素中(填具體物質化學式) 原子半徑最小的是(除稀有氣體元素);陰離子還原性最弱的是;最高價氧化物對應的水化物中酸性最強的是 .
(2)F和G兩元素相比較,金屬性較強的是(填名稱),可以驗證該結論的實驗是 . (填編號) a.將在空氣中放置已久的這兩種元素的塊狀單質分別放入熱水中
b.將這兩種元素的單質粉末分別和同濃度的鹽酸反應
c.將這兩種元素的單質粉末分別和熱水作用,并滴入酚酞溶液
d.比較這兩種元素的氣態氫化物的穩定性
(3)B元素形成的單質的結構式為 , E2C2的電子式為 .
(4)寫出E的最高價氧化物對應的水化物與G單質發生的反應的離子方程式:
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學用語正確的是( )
A.26Fe的價層電子排布式為3d64s2
B.35Br的電子排布式可簡寫為[Ar]4s24p5
C.NH4Cl的電子式為 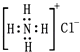
D.氯離子結構示意圖為 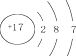
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用如圖裝置完成下表所列的四個實驗,不能達到實驗目的是( )
選項 | 實驗目的 | 試劑X | 試劑Y |
A | 驗證C2H5OH與濃H2SO4加熱至170℃制得的乙烯的性質 | NaOH溶液 | Br2水 |
B | 檢驗FeSO4受熱分解產生的氣體中由SO3和SO2 | BaCl2溶液 | 品紅溶液 |
C | 驗證電石與飽和食鹽水反應生成的乙炔的性質 | CuSO4溶液 | KMnO4溶液 |
D | 驗證氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |

A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com