
乙醇汽油含氧量達(dá)35%,使燃料燃燒更加充分,使用車用乙醇汽油,尾氣排放的CO和碳?xì)浠衔锲骄鶞p少30%以上,有效的降低和減少了有害的尾氣排放。但是汽車使用乙醇汽油并不能減少NOx的排放,對(duì)NOx的有效消除成為環(huán)保領(lǐng)域的重要課題。NOx排入空氣中,形成酸雨,造成空氣污染。NOx中有一種紅棕色氣體,其溶于水的方程式是 。
(2)已知NO2和N2O4的結(jié)構(gòu)式分別是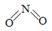 和
和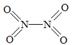 。
。
| 物質(zhì) | NO2 | N2O4 | |
| 化學(xué)鍵 | N=O | N—N | N=O |
| 鍵能(kJ/mol) | 466 | 167 | 438 |
(1)3NO2+H2O=2HNO3+NO
(2)2NO2(g) =N2O4(g) ?H= -55 kJ/mol
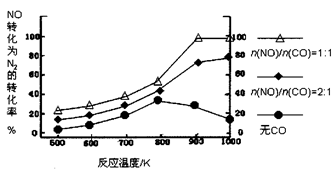
(3)①
②900K ; n(NO)/n(CO)=1∶1;>
(4)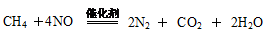
解析試題分析:(1)二氧化氮與水反應(yīng)生成硝酸和一氧化氮,化學(xué)方程式為:3NO2+H2O=2HNO3+NO
(2)NO2轉(zhuǎn)化N2O4的熱效應(yīng)通過(guò)鍵能可計(jì)算出。?H=反應(yīng)物的總鍵能-生成物的總鍵能="2×2×466" kJ/mol-(4×438+167)kJ/mol="-55" kJ/mol,所以熱化學(xué)方程式為2NO2(g) = N2O4(g) ?H= -55 kJ/mol;
(3)①用CO還原NO生成N2的化學(xué)方程式為
②根據(jù)圖示可知,900K時(shí)轉(zhuǎn)化率達(dá)100%,此時(shí)n(NO)/n(CO)=1:1,隨溫度升高,NO的轉(zhuǎn)化率增大,說(shuō)明升溫反應(yīng)正向移動(dòng),正向?yàn)槲鼰岱磻?yīng),所以?H>0
(4)CH4與NO反應(yīng)生成無(wú)污染的產(chǎn)物,所以該反應(yīng)的化學(xué)方程式為CH4+4NO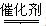 2N2+CO2+2H2O
2N2+CO2+2H2O
考點(diǎn):考查化學(xué)方程式的書(shū)寫,熱化學(xué)方程式的熱效應(yīng)的計(jì)算,分析圖示的能力



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:填空題
(14分)運(yùn)用化學(xué)反應(yīng)原理分析解答以下問(wèn)題
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -41 kJ·mol-l
CO2(g)+H2(g) △H3= -41 kJ·mol-l
且三個(gè)反應(yīng)的平衡常數(shù)依次為K1、K2、K3 則反應(yīng) 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
則反應(yīng) 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
化學(xué)平衡常數(shù)K= (用含K1、K2、K3的代數(shù)式表示)。
(2)一定條件下,若將體積比為1:2的CO和H2氣體通入體積一定的密閉容器中發(fā)生反應(yīng) 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能說(shuō)明反應(yīng)達(dá)到平衡狀態(tài)是 。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能說(shuō)明反應(yīng)達(dá)到平衡狀態(tài)是 。
a.體系壓強(qiáng)保持不變 B.混合氣體密度保持不變
c. CO和H2的物質(zhì)的量保持不變 d.CO的消耗速度等于CO2的生成速率
(3)氨氣溶于水得到氨水。在25℃下,將x mol.L-l的氨水與y mol.L-1的鹽酸等體積混合,反應(yīng)后溶液顯中性,則c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代數(shù)式表示出氨水的電離平衡常數(shù) .
(4)科學(xué)家發(fā)明了使NH3直接用于燃料電池的方法,其裝置用鉑黑作電極、加入電解質(zhì)溶液中,一個(gè)電極通入空氣,另一電極通入NH3。其電池反應(yīng)式為:4NH3+3O2 = 2N2+6H2O,電解質(zhì)溶液應(yīng)顯 (填“酸性”、“中性”、“堿性”),
寫出正極的電極反應(yīng)方程式 .
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
請(qǐng)參考題中圖表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根據(jù)要求回答問(wèn)題: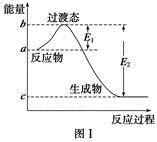
(1)圖Ⅰ是1 mol NO2(g)和1 mol CO(g)反應(yīng)生成CO2和NO過(guò)程中的能量變化示意圖,若在反應(yīng)體系中加入催化劑,反應(yīng)速率增大,E1的變化是 (填“增大”、“減小”或“不變”,下同),ΔH的變化是 。請(qǐng)寫出NO2和CO反應(yīng)的熱化學(xué)方程式: 。
(2)甲醇質(zhì)子交換膜燃料電池中將甲醇蒸汽轉(zhuǎn)化為氫氣的兩種反應(yīng)的熱化學(xué)方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,則甲醇蒸汽燃燒為液態(tài)水的熱化學(xué)方程式為 。
(3)如表所示是部分化學(xué)鍵的鍵能參數(shù):
| 化學(xué)鍵 | P—P | P—O | O===O | P===O |
| 鍵能/kJ·mol-1 | a | b | c | x |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
在微生物作用的條件下,NH4+經(jīng)過(guò)兩步反應(yīng)被氧化成NO3-。這兩步的能量變化示意圖如下: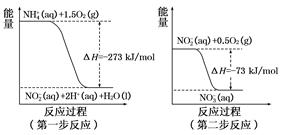
(1)第二步反應(yīng)是 反應(yīng)(選填“放熱”或“吸熱”),判斷依據(jù)是 。
(2)1 mol NH4+ (aq)全部氧化成NO2- (aq)的熱化學(xué)方程式是 。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
研究表明豐富的CO2完全可以作為新碳源,解決當(dāng)前應(yīng)用最廣泛的碳源(石油和天然氣)到本世紀(jì)中葉將枯竭的危機(jī),同時(shí)又可緩解由CO2累積所產(chǎn)生的溫室效應(yīng),實(shí)現(xiàn)CO2的良性循環(huán)。
(1)目前工業(yè)上有一種方法是用CO2和H2在230℃催化劑條件下轉(zhuǎn)化生成甲醇蒸汽和水蒸氣。下圖表示恒壓容器中0.5 mol CO2和1.5 mol H2轉(zhuǎn)化率達(dá)80%時(shí)的能量變化示意圖。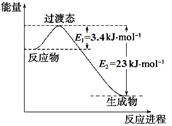
①寫出該反應(yīng)的熱化學(xué)方程式: 。
②能判斷該反應(yīng)達(dá)到化學(xué)平衡狀態(tài)的依據(jù)是 。
a.容器中壓強(qiáng)不變 b.H2的體積分?jǐn)?shù)不變
c.c(H2)=3c(CH3OH) d.容器中密度不變
e.2個(gè)C=O斷裂的同時(shí)有6個(gè)H-H斷裂。
(2)人工光合作用能夠借助太陽(yáng)能,用CO2和H2O制備化學(xué)原料.下圖是通過(guò)人工光合作用制備HCOOH原理的示意圖。根據(jù)要求回答問(wèn)題: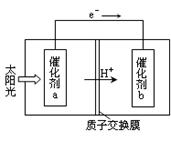
①該過(guò)程是將 轉(zhuǎn)化為 。(以上兩空選填“電能”“太陽(yáng)能”“化學(xué)能”)
②催化劑b表面的電極反應(yīng)方程式為 。
(3)某國(guó)科研人員提出了使用氫氣和汽油(汽油化學(xué)式用C8H18表示)混合燃料的方案,以解決汽車CO2的排放問(wèn)題。該方案主要利用儲(chǔ)氫材料CaH2產(chǎn)生H2和用汽油箱貯存汽油供發(fā)動(dòng)機(jī)使用,儲(chǔ)氫系統(tǒng)又捕集汽油燃燒產(chǎn)生的CO2,該系統(tǒng)反應(yīng)如下圖所示: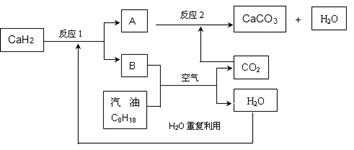
解決如下問(wèn)題:
①寫出CaH2的電子式 。
②反應(yīng)1中氧化劑與還原劑的物質(zhì)的量之比是: 。
③如該系統(tǒng)反應(yīng)均進(jìn)行完全,試寫出該系統(tǒng)總反應(yīng)的化學(xué)方程式 。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
I.“低碳循環(huán)”引起各國(guó)的高度重視,而如何降低大氣中CO2的含量及有效地開(kāi)發(fā)利用CO2,引起了全世界的普遍重視。所以“低碳經(jīng)濟(jì)”正成為科學(xué)家研究的主要課題:
(1)將不同量的CO(g)和H2O(g)分別通入到體積為2L的恒容密閉容器中,進(jìn)行反應(yīng):
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二組數(shù)據(jù):
CO2(g)+H2(g),得到如下二組數(shù)據(jù):
| 實(shí)驗(yàn)組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達(dá)到平衡所需時(shí)間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
四氯化鈦(TiCl4)是制取航天航空工業(yè)材料——鈦合金的重要原料。由鈦鐵礦(主要成分是FeTiO3)制備TiCl4等產(chǎn)品的一種工藝流程示意圖如下:
(1)往①中加入鐵屑至浸出液顯紫色,此時(shí)溶液仍呈強(qiáng)酸性。該過(guò)程中有如下反應(yīng)發(fā)生:
Fe+2Fe3+=3Fe2+
2TiO2+(無(wú)色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(無(wú)色)+Fe2++2H+
加入鐵屑的作用是 。
(2)在②→③工藝過(guò)程中需要控制條件以形成TiO2·nH2O溶膠,該溶膠的分散質(zhì)顆粒直徑大小在 范圍。
(3)若把③中制得的固體TiO2·nH2O用酸清洗除去其中的雜質(zhì),還可制得鈦白粉。已知25 ℃時(shí),Ksp[Fe(OH)3]=2.79×10-39,該溫度下反應(yīng)Fe(OH)3+3H+ Fe3++3H2O的平衡常數(shù)K= 。
Fe3++3H2O的平衡常數(shù)K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
寫出④中TiO2和焦炭、氯氣反應(yīng)生成液態(tài)TiCl4和CO氣體的熱化學(xué)方程式: 。
(5)上述工藝具有成本低、可用低品位礦物為原料等優(yōu)點(diǎn)。依據(jù)綠色化學(xué)理念,該工藝流程中存在的不足之處是 (只要求寫出一項(xiàng))。
(6)依據(jù)下表信息,要精制含少量SiCl4雜質(zhì)的TiCl4,可采用 方法。
| | TiCl4 | SiCl4 |
| 熔點(diǎn)/℃ | -25.0 | -68.6 |
| 沸點(diǎn)/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
當(dāng)前環(huán)境問(wèn)題是一個(gè)全球重視的問(wèn)題,引起環(huán)境問(wèn)題的氣體常見(jiàn)的有溫室氣體CO2、
污染性氣體NOx、SOx等。如果對(duì)這些氣體加以利用就可以成為重要的能源,既解決了對(duì)環(huán)境的污染,又解決了部分能源危機(jī)問(wèn)題。
(1)二氧化碳是地球溫室效應(yīng)的罪魁禍?zhǔn)祝壳叭藗兲幚矶趸嫉姆椒ㄖ皇鞘蛊渑c氫氣反應(yīng)合成甲醇,甲醇是汽車燃料電池的重要燃料。CO2與H2反應(yīng)制備CH3OH和H2O的化學(xué)方程式為
(2)在高溫下一氧化碳可將二氧化硫還原為單質(zhì)硫。
已知:
①C(s)+O2(g)=CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g)ΔH3=-296.0 kJ·mol-1
請(qǐng)寫出CO與SO2反應(yīng)的熱化學(xué)方程式 。
(3)硝酸廠常用催化還原方法處理尾氣。CH4在催化條件下可以將NO2還原為N2。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)=2NO2(g)ΔH=+67.7 kJ·mol-1②
則CH4還原NO2生成水蒸氣和氮?dú)獾臒峄瘜W(xué)方程式是 。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
在25 ℃、101 kPa的條件下,斷裂1 mol H—H鍵吸收436 kJ能量,斷裂1 mol Cl—Cl鍵吸收243 kJ能量,形成1 mol H—Cl鍵放出431 kJ能量。H2+Cl2===2HCl的化學(xué)反應(yīng)可用下圖表示: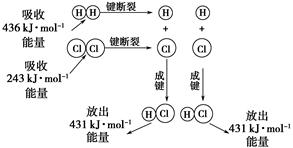
請(qǐng)回答下列有關(guān)問(wèn)題:
(1)反應(yīng)物斷鍵吸收的總能量為_(kāi)_______。
(2)生成物成鍵放出的總能量為_(kāi)_______。
(3)判斷H2+Cl2===2HCl是________(填“吸收”或“放出”)能量。
(4)反應(yīng)物的總能量________(填“>”,“=”或“<”)生成物的總能量。
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com