
【題目】下列關于氯氣、氯水的敘述中正確的是( )
A. 氯氣、液氯、氯水是同一種物質
B. 新制氯水可以使藍色石蕊試紙先變紅后褪色
C. 光照氯水有氣泡逸出,逸出的氣體是氯氣
D. 新制氯水放置數天后pH變大
科目:高中化學 來源: 題型:
【題目】(14分)已知X、Y、Z、M、G、Q是六種短周期元素,原子序數依次增大。X、Z、Q的單質在常溫下呈氣態;Y的原子最外層電子數是其電子層數的2倍;X與M同主族;Z、G分別是地殼中含量最高的非金屬元素和金屬元素。
請回答下列問題:
(1)Y、Z、M、G四種元素原子半徑由大到小的順序是(寫元素符號) 。
(2)Z在元素周期表中的位置為 。
(3)上述元素的最高價氧化物對應的水化物酸性最強的是(寫化學式) 。
(4)X與Y能形成多種化合物,其中既含極性鍵又含非極性鍵,且相對分子質量最小的物質是(寫分子式) ,在實驗室中,制取該物質的反應原理是(寫化學方程式) 。
(5)M2Z的電子式為 。MX與水反應可放出氣體,該反應的化學方程式為 。
(6)常溫下,不能與G的單質發生反應的是(填序號) 。
a.CuSO4溶液 b.Fe2O3c.濃硫酸 d.NaOH溶液 e.Na2CO3固體
工業上用電解法制G的單質的化學方程式是 ,若以石墨為電極,陽極產生的混合氣體的成分是(寫化學式) 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列各反應中,乙醇分子斷裂C—O鍵而失去羥基的是
A.乙醇在濃硫酸存在下發生消去反應
B.乙醇與金屬鈉反應
C.乙醇氧化為乙醛
D.與乙酸反應生成乙酸乙酯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在元素周期表中,第三、四、五、六周期元素的數目分別是
A. 8、8、18、32 B. 8、18、18、32 C. 8、18、18、18 D. 8、8、18、18
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取ag某物質在氧氣中完全燃燒,將其產物跟足量的過氧化鈉固體完全反應,反應后固體的質量恰好也增加ag.下列物質中不能滿足上述結果的是( )
A. H2 B. CO C. CH4 D. H2和CO的混合氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現以CO、O2、熔融鹽Z(Na2CO3)組成的燃料電池,采用電解法制備N2O5,裝置如圖所示,其中Y為CO2,下列說法錯誤的是( )
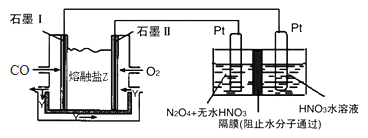
A. 石墨I是原電池的負極,發生氧化反應
B. 若甲池消耗標準狀況下的氧氣2.24L,則乙池中產生氫氣0.05mol
C. 乙池中左端Pt極電極反應式:N2O4-2e-+2HNO3=2N2O5+2H+
D. 甲池中的CO32-向石墨I極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能證明某溶液中含有NaCl的是
A. 焰色反應是黃色
B. 溶液有咸味
C. 取少量溶液于試管中,滴加稀硝酸酸化的硝酸銀溶液,出現白色沉淀
D. 焰色反應是黃色,同時又能與稀硝酸酸化的硝酸銀溶液反應生成白色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Al—Ag2O電池可用作水下動力電源,其原理如圖所示。電池工作時,下列說法錯誤的是
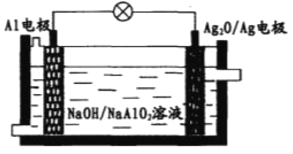
A. 電子由Al電極通過外電路流向Ag2O/Ag電極
B. 電池負極附近溶液pH升高
C. 正極反應式為Ag2O+2e-+H2O=2Ag+2OH-
D. 負極會發生副反應2Al+2NaOH+2H2O=2NaAlO2+3H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以黃銅礦(主要成分二硫化亞鐵銅CuFeS2為原料,用Fe2(SO4)3溶液作浸取劑提取銅,總反應的離子方程式是:CuFeS2+4Fe3+=Cu2++5Fe2++2S
(1)上述總反應的原理如圖1所示。正極的電極反應式是_______________________________。
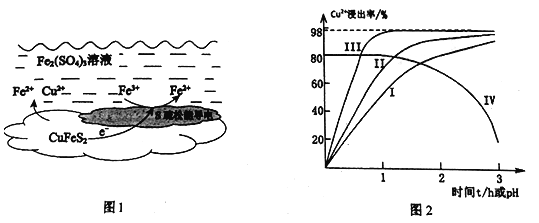
(2)一定溫度下,控制浸取劑pH=1,總體積為1L,取三份相同質量黃銅礦粉末分別進行實驗,結果如圖2:
實驗 | 操作 |
I | 加入足量0.100 molL-1Fe2(SO4)3溶液 |
II | 加入足量0.100 molL-1Fe2(SO4)3溶液,通入空氣 |
Ⅲ | 加入足量0.100 molL-1Fe2(SO4)3溶液,再加入少量 0.000500 molL-1Ag2SO4溶液 |
①曲線IV是在實驗I的基礎上改變溶液的pH所得實驗結果,請分析pH從2到3,Cu2+浸出率明顯下降的原因____________________________(用離子方程式描述)。
②對比實驗I、Ⅱ,通入空氣,Cu2+浸出率提髙的原因是_________________________。
③由實驗Ⅲ推測,在浸取Cu2+過程中Ag+作催化劑,催化原理是:
i . CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ii.……
寫出上述ii的離子方程式_____________________________________________。
為證明該催化原理,進行如下實驗:
a.取少量黃銅礦粉末,加入少量0.0005mol·L-lAg2SO4溶液,充分混合后靜置。取上層淸液,加入稀鹽酸,觀察到溶液中_______________________,證明發生反應i
b.取少量Ag2S粉末,加入________________溶液,充分混合后靜置。取上層淸液,加入稀鹽酸,有白色沉淀,證明發生反應ii
④若實驗中樣品含銅a mol,則實驗I的平衡常數K=_____________(雜質不參與反應,只要求列出計算式,不必算出結果)。
(3)為了進一步研究上述實驗Ⅲ結論的可靠性,査得資料Ksp(Ag2S)=6.4×10-50,Ksp(AgCl)=1.8×10-10,試計算,使飽和Ag2S溶液中的Ag+開始轉化為AgCl沉淀所需鹽酸的最低濃度為____________ mol/L (己知![]() ≈2.5)。
≈2.5)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com