
【題目】用糖類物質制備乙酸乙酯的合成路線之一如下圖所示:
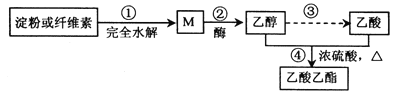
下列說法正確的是( )
A. 淀粉和纖維素互為同分異構體
B. 反應②:1 mol M 在酒化酶作用下可生成3 molCH3CH2OH
C. 反應③:乙醇變乙酸所需反應條件可為酸性重鉻酸鉀溶液
D. 反應④:產物通入滴有酚酞的飽和碳酸鈉溶液中振蕩,無明顯現象
科目:高中化學 來源: 題型:
【題目】已知有機化合物A、B、C、D、E存在下圖所示轉化關系,且C能跟NaHCO3發生反應,C和D的相對分子質量相等,E為無支鏈的化合物。
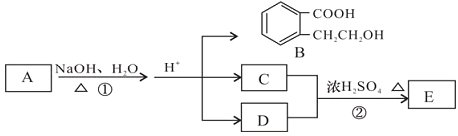
請回答下列問題:
(1)已知E的相對分子質量為102,其中碳、氫兩種元素的質量分數分別為58.8%、9.8%,其余為氧,則E的分子式為_________________。
(2)B在一定條件下可以發生縮聚反應生成某高分子化合物,此高分子化合物的結構簡式為_________________。
(3)D也可以由溴代烴F在NaOH溶液中加熱來制取,寫出此反應的化學方程式_________________。
(4)反應①的化學方程式_________________。
(5)B有多種同分異構體,請寫出一種同時符合下列四個條件的結構簡式:_________________。
a.能夠發生水解
b.能發生銀鏡反應
c.能夠與FeCl3溶液顯紫色
d.苯環上的一氯代物只有一種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎授予了在鋰離子電池領域作出巨大貢獻的三位科學家。某鋰離子電池以![]() 為負極,
為負極,![]() 為正極,鋰鹽有機溶液作電解質溶液,電池反應為
為正極,鋰鹽有機溶液作電解質溶液,電池反應為![]() 。則下列有關說法正確的是( )
。則下列有關說法正確的是( )
A.金屬鋰的密度、熔點和硬度均比同族的堿金屬低
B.該鋰離子電池可用乙醇作有機溶劑
C.電池放電時,![]() 從正極流向負極
從正極流向負極
D.電池充電時,陽極的電極反應式為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以烴A為原料合成有機化合物M和N的路線如下:
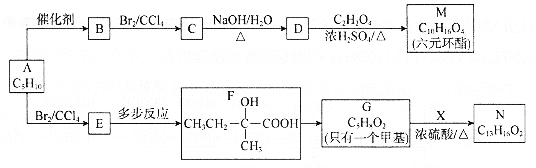
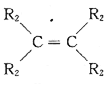
已知:a.在催化劑作用下,烯烴分子間的雙鍵碳原子可以互換而發生烯烴復分解反應: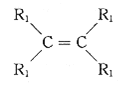 +
+
![]() 2
2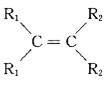
b.X的苯環上有2種等效氫,且只含1個甲基。
回答下列問題:
(1)根據系統命名法,B的名稱是________。N中含氧官能團的名稱為________。
(2)M的結構簡式是________。
(3)F→G的反應類型是________。
(4)寫出C→D的化學方程式________。
(5)同時滿足下列兩個條件的N的同分異構體共有________種;
①能夠發生銀鏡反應且該物質與生成Ag的物質的量之比為1:4;
②苯環上連接—C5H11。
上述同分異構體中,核磁共振氫譜有5組峰且峰面積之比為9:2:2:2:1的有________和________(寫結構簡式)
(6)寫出以CH2=CH(CH2)4CH=CH2為原料制備![]() 的合成路線________(其他試劑任選)
的合成路線________(其他試劑任選)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋約占地球表面積的71%,海水化學資源的利用具有非常廣闊的前景.
(1)海水曬鹽可獲得粗鹽,在實驗室中粗鹽經過溶解、________、________可制得精鹽。(填具體操作名稱)
(2)鎂及其合金是一種用途很廣的金屬材料,目前世界上60%的鎂是從海水中提取的,其主要步驟如下:
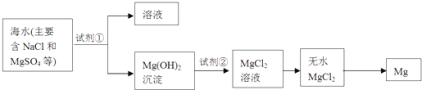
①為了使MgSO4轉化為Mg(OH)2 , 試劑①可以選用________。
②試從節約能源、提高金屬鎂的純度分析,以下適宜的冶鎂方法是________。
A.Mg(OH)![]() MgO
MgO![]() Mg B.Mg(OH)
Mg B.Mg(OH)![]() MgO
MgO![]() Mg
Mg
C.Mg(OH)2![]() MgCl2
MgCl2![]() Mg D.Mg(OH)2
Mg D.Mg(OH)2![]() MgCl2
MgCl2![]() Mg
Mg
(3)溴及其化合物用途十分廣泛,我國正在大力開展海水提溴的研究和開發工作。工業以濃縮海水為原料提取溴的部分過程如下:
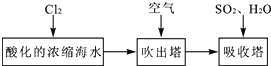
某課外小組在實驗室模擬上述過程設計以下裝置進行實驗(所有橡膠制品均已被保護,夾持裝置已略去):
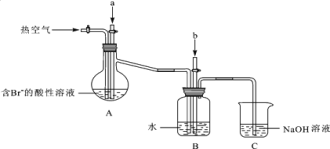
①A裝置中通入a氣體的目的是(用離子方程式表示)______________________________;
②A裝置中通入a氣體一段時間后,停止通入,改通熱空氣.通入熱空氣的目的是___________;
③反應過程中,B裝置中有SO42﹣生成,檢驗SO42﹣的方法是____________________________;
④C裝置的作用是______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,向圓底燒瓶中加入1 molC2H5OH和含1molHBr的氫溴酸,溶液中發生反應;C2H5OH+HBr![]() C2H5Br+H2O,充分反應后達到平衡。已知常壓下,C2H5Br和C2H5OH的沸點分別為38.4℃和78.5℃。下列有關敘述錯誤的是
C2H5Br+H2O,充分反應后達到平衡。已知常壓下,C2H5Br和C2H5OH的沸點分別為38.4℃和78.5℃。下列有關敘述錯誤的是
A. 加入NaOH,可增大乙醇的物質的量
B. 增大HBr濃度,有利于生成C2H5Br
C. 若反應物增大至2 mol,則兩種反應物平衡轉化率之比不變
D. 若起始溫度提高至60℃,可縮短反應達到平衡的時間
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學—選修3:物質結構與性質](15分)A、B、C、D為原子序數依次增大的四種元索,A2-和B+具有相同的電子構型;C、 D為同周期元索,C核外電子總數是最外層電子數的3倍;D元素最外層有一個未成對電子。回答下列問題:
(1)四種元素中電負性最大的是 (填元素符號),其中C原子的核外電子排布式為__________。
(2)單質A有兩種同素異形體,其中沸點高的是 (填分子式),原因是 ;A和B的氫化物所屬的晶體類型分別為 和 。
(3)C和D反應可生成組成比為1:3的化合物E, E的立體構型為 ,中心原子的雜化軌道類型為 。
(4)化合物D2A的立體構型為 ,中心原子的價層電子對數為 ,單質D與濕潤的Na2CO3反應可制備D2A,其化學方程式為 。
(5)A和B能夠形成化合物F,其晶胞結構如圖所示,晶胞參數,a=0.566nm, F 的化學式為 :晶胞中A 原子的配位數為 ;列式計算晶體F的密度(g.cm-3) 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設nA為阿伏伽德羅常數的數值,下列說法正確的是
A. 23g Na 與足量H2O反應完全后可生成nA個H2分子
B. 1 molCu和足量熱濃硫酸反應可生成nA個SO3分子
C. 標準狀況下,22.4L N2和H2混合氣中含nA個原子
D. 3mol單質Fe完全轉變為Fe3O4,失去8nA個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列涉及離子方程式書寫的評價合理的是( )
選項 | 化學反應及離子方程式 | 評價 |
A | 次氯酸鈣溶液中通入足量SO2:Ca2++ClO-+SO2+H2O===CaSO4↓+Cl-+2H+ | 正確 |
B | 實驗室用濃鹽酸與MnO2反應制Cl2:MnO2+4H++2Cl- | 錯誤,H+、Cl-的化學計量數應相等 |
C | 硝酸鐵溶液中加過量氨水:Fe3++3NH3·H2O===Fe(OH)3(膠體)+3NH4+ | 錯誤,Fe(OH)3應該是沉淀 |
D | 鋁溶于碳酸中:2Al+3H2CO3===2Al3++3H2↑+3CO32- | 正確 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com