
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1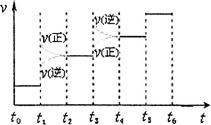
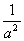 (mol/L)-2
(mol/L)-2
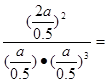
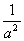 (mol/L)-2.
(mol/L)-2.

科目:高中化學 來源:不詳 題型:填空題
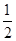 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

 4NO(g) △H=+292.3kJ·mol—1,
4NO(g) △H=+292.3kJ·mol—1, N2(g)+2CO2(g) 的△H= ;
N2(g)+2CO2(g) 的△H= ; 2N2O5(g);已知體系中n(NO2)隨時間變化如下表:
2N2O5(g);已知體系中n(NO2)隨時間變化如下表:| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

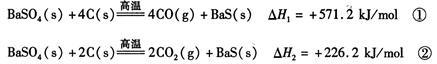
 2CO(g)的△H = kJ/mol
2CO(g)的△H = kJ/mol = 。[已知:
= 。[已知:查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 CH3OH(g)+H2O(g),在其他條件不變的情況下,考察溫度對反應的影響,實驗結果如下圖所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他條件不變的情況下,考察溫度對反應的影響,實驗結果如下圖所示(注:T1、T2均大于300 ℃):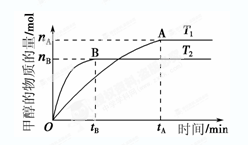
| A.溫度為T1時,從反應開始到平衡,生成甲醇 的平均速率為v(CH3OH)=  mol·L-1·min-1 mol·L-1·min-1 |
| B.該反應在T1時的平衡常數比T2時的小 |
| C.該反應為放熱反應 |
D.處于A點的反應體系從T1變到T2,達到平衡時 增大 增大 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 |
| C.-611.5 kJ·mol-1 | D.+520.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1 O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1 2NO(g) △H
2NO(g) △H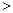 0,若1.0 mol空氣含0.80 mol N2和0.20 mol O2,1300oC時在1.0 L密閉容器內經過5s反應達到平衡,測得NO為8.0×10-4 mol。
0,若1.0 mol空氣含0.80 mol N2和0.20 mol O2,1300oC時在1.0 L密閉容器內經過5s反應達到平衡,測得NO為8.0×10-4 mol。 2CO2(g)+N2(g) 中,NO的濃度
2CO2(g)+N2(g) 中,NO的濃度
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+41kJ/mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com