
【題目】密閉容器中自由移動的活塞兩邊分別充入空氣和H2、O2的混合氣體,開始體積比為1:3,若將H2、O2的混合氣體點燃引爆,恢復到原來溫度(水為液態),活塞右滑停留于容器的正中央,則原來H2、O2的體積比可能為( ) 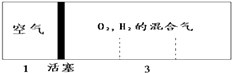
A.2:7
B.5:4
C.1:1
D.7:2
【答案】D
【解析】解:反應前左右壓強都相等,氣體的物質的量之比等于體積之比,令空氣的物質的量為1mol,則氫氣、氧氣的混合氣體為3mol.反應后恢復至原來的溫度,活塞正好停留在容器的中間.說明反應后左右氣體的物質的量相等,右室中剩余氣體為1mol,若剩余的氣體為氫氣,參加反應氣體共2mol,由2H2+O2 ![]() 2H2O可知,氧氣為2mol×
2H2O可知,氧氣為2mol× ![]() =
= ![]() mol,故氫氣為3mol﹣
mol,故氫氣為3mol﹣ ![]() mol=
mol= ![]() mol,故H2、O2的體積比為
mol,故H2、O2的體積比為 ![]() mol:
mol: ![]() mol=7:2;
mol=7:2;
若剩余的氣體為氧氣,參加反應氣體共2mol,由2H2+O2 ![]() 2H2O可知,氫氣為2mol×
2H2O可知,氫氣為2mol× ![]() =
= ![]() mol,故氧氣為3mol﹣
mol,故氧氣為3mol﹣ ![]() mol=
mol= ![]() mol,故H2、O2的體積比為
mol,故H2、O2的體積比為 ![]() mol:
mol: ![]() mol=4:5,
mol=4:5,
故選D.
反應前左右壓強都相等,氣體的物質的量之比等于體積之比,令空氣的物質的量為1mol,則氫氣、氧氣的混合氣體為3mol.反應后恢復至原來的溫度,活塞正好停留在容器的中間.說明反應后左右氣體的物質的量相等,右室中剩余氣體為1mol,剩余的氣體可能為氫氣,也可能為氧氣,據此討論計算.


 課時掌控隨堂練習系列答案
課時掌控隨堂練習系列答案 一課一練一本通系列答案
一課一練一本通系列答案 浙江之星學業水平測試系列答案
浙江之星學業水平測試系列答案科目:高中化學 來源: 題型:
【題目】一定溫度下,向AgCl飽和溶液中加水,下列敘述正確的是
A.AgCl的溶解度減小B.AgCl的溶解度增大,Ksp不變
C.c(Ag+)增大D.AgCl的溶解度、Ksp均不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應N2+3H2![]() 2NH3的能量變化如圖所示,該反應的熱化學方程式是( )
2NH3的能量變化如圖所示,該反應的熱化學方程式是( )

A. N2(g)+3H2(g) ![]() 2 NH3(l) ΔH=(b+c-a) kJ·mol-1
2 NH3(l) ΔH=(b+c-a) kJ·mol-1
B. N2(g)+3H2(g) ![]() 2NH3(g) ΔH=(a+b) kJ·mol-1
2NH3(g) ΔH=(a+b) kJ·mol-1
C. N2(g)+3H2(g) ![]() 2NH3(l) ΔH=2(a-b-c) kJ·mol-1
2NH3(l) ΔH=2(a-b-c) kJ·mol-1
D. N2(g)+3H2(g) ![]() 2NH3(g) ΔH=2(b-a) kJ·mol-1
2NH3(g) ΔH=2(b-a) kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“低碳經濟,節能減排”是當今世界經濟發展的新思路。下列行為與之相悖的是
A. 開發風能、太陽能等新能源
B. 回收處理工業廢氣
C. 大力發展新能源汽車
D. 過度開采煤、石油和天然氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、SO2 、CO等大氣污染氣體的處理具有重要意義。
(1)NO2可用水吸收,相應的化學反應方程式為__________________________________。
利用反應6NO2+8NH3![]() 7N2+12 H2O也可處理NO2。當轉移1.2mol電子時,消耗的NO2在標準狀況下是______________ L
7N2+12 H2O也可處理NO2。當轉移1.2mol電子時,消耗的NO2在標準狀況下是______________ L
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
則反應NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=________kJ·mol-1。一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是________。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是________。
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變 d.每消耗1 mol SO3的同時生成1 molNO2
測得上述反應平衡時NO2與SO2體積比為1:6,則平衡常數K=__________。
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)![]() CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如下圖所示。該反應ΔH______0(填“>”或“ <”)。實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是________________。
CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如下圖所示。該反應ΔH______0(填“>”或“ <”)。實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是________________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com