
【題目】金屬鈉是在1807年通過電解氫氧化鈉制得的,這個原理應用于工業生產,約在1891年才獲得成功。1921年實現了電解氯化鈉制鈉的工業方法,其反應原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有關單質鈉的問題:
2Na+Cl2↑。回答下列有關單質鈉的問題:
(1)下列各項中屬于保存金屬鈉的正確方法是___。
A.放在棕色瓶中 B.放在細沙中 C.放在水中 D.放在煤油中
(2)鈉長時間放在空氣中,最后的產物主要成分是___。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)將一小塊鈉放在水平放置的試管中部,用酒精燈加熱充分反應(如圖Ⅰ所示),請寫出該反應的化學方程式___,生成物的顏色為___。將該試管冷卻后直立,滴加幾滴水(如圖Ⅱ所示),發生反應的離子方程式為___,檢驗該反應產生的氣體的方法是___。
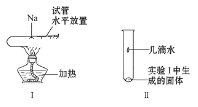
【答案】D D 2Na+O2![]() Na2O2 淡黃色 2Na2O2+2H2O=4Na++4OH-+O2↑ 用帶火星的木條放在試管口,看是否復燃
Na2O2 淡黃色 2Na2O2+2H2O=4Na++4OH-+O2↑ 用帶火星的木條放在試管口,看是否復燃
【解析】
(1)結合鈉的性質判斷鈉的保存方法;
(2)Na的性質活潑,易與空氣中的氧氣反應生成Na2O,Na2O易與水反應生成NaOH,NaOH吸收空氣中的水和CO2生成Na2CO3xH2O,Na2CO3xH2O風化脫水生成Na2CO3;
(3)鈉在氧氣中加熱生成淡黃色固體過氧化鈉,過氧化鈉與水反應生成氫氧化鈉和氧氣,氧氣具有助燃性,故檢驗方法為:用帶火星的木條放在試管口,看是否復燃,若木條復燃,則說明生成了氧氣。
(1)鈉的化學性質活潑,應密封保存,密度比水小,比煤油大,故應保存在煤油中;
故答案為:D;
(2)Na的性質活潑,易與空氣中的氧氣反應生成Na2O,Na2O易與水反應生成NaOH,NaOH吸收空氣中的水和CO2生成Na2CO3xH2O,Na2CO3xH2O風化脫水生成Na2CO3;
故答案為:D;
(3)鈉在氧氣中加熱生成淡黃色固體過氧化鈉,反應方程式為:2Na+O2![]() Na2O2,過氧化鈉與水反應生成氫氧化鈉和氧氣,反應的離子方程式為:2Na2O2+2H2O=4Na++4OH-+O2↑;氧氣具有助燃性,故檢驗方法為:用帶火星的木條放在試管口,看是否復燃,若木條復燃,則說明生成了氧氣;
Na2O2,過氧化鈉與水反應生成氫氧化鈉和氧氣,反應的離子方程式為:2Na2O2+2H2O=4Na++4OH-+O2↑;氧氣具有助燃性,故檢驗方法為:用帶火星的木條放在試管口,看是否復燃,若木條復燃,則說明生成了氧氣;
故答案為:2Na+O2![]() Na2O2;淡黃色;2Na2O2+2H2O=4Na++4OH-+O2↑;用帶火星的木條放在試管口,看是否復燃。
Na2O2;淡黃色;2Na2O2+2H2O=4Na++4OH-+O2↑;用帶火星的木條放在試管口,看是否復燃。


科目:高中化學 來源: 題型:
【題目】3.2g銅與過量硝酸(8mol·L-1、30mL)充分反應,硝酸的還原產物為二氧化氮和一氧化氮,反應后溶液中含amol氫離子,則此時溶液中所含硝酸根離子的物質的量為( )
A.(0.2+a)molB.(0.1+a)mol
C.(0.05+a)molD.amol
【答案】B
【解析】
銅與濃硝酸可能發生反應的化學方程式:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。硝酸銅的物質的量為![]() =0.05mol,溶液中所含硝酸根離子的物質的量為0.05mol×2+amol=(0.1+a)mol,故答案為B。
=0.05mol,溶液中所含硝酸根離子的物質的量為0.05mol×2+amol=(0.1+a)mol,故答案為B。
【點睛】
考查化學方程式的計算。注意濃硝酸和稀硝酸的性質的不同,明確二氧化氮或一氧化氮和硝酸的關系以及銅與硝酸(表現酸性)的關系式是解本題的關鍵。銅和硝酸反應,隨著濃度的減少,硝酸的還原產物的價態越低,銅和濃硝酸反應生成NO2,而與稀硝酸反應時則生成NO,故生成的氣體有NO2和NO,根據混合氣體的物質的量可得被還原的硝酸的物質的量,根據生成硝酸銅的物質的量可知表現酸性的硝酸的物質的量。
【題型】單選題
【結束】
11
【題目】為了防止鋼鐵零件生銹,常采用化學處理使鋼鐵零件表面生成Fe3O4的致密保護層——“發藍”。化學處理過程中其中一步的反應為3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列敘述不正確的是( )
A.鋼鐵零件“發藍”實質上是使鐵表面鈍化
B.上述反應中,鐵被氧化
C.NO2-的氧化性大于FeO22-的氧化性
D.反應中轉移2mol電子,生成還原產物8.5g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】小王同學在做實驗時引發了鎂失火,她立即拿起二氧化碳滅火器欲把火撲滅,卻被實驗老師及時制止。原因是CO2可以支持鎂燃燒發生以下反應:2Mg+CO2![]() 2MgO+C,下列關于該反應的判斷正確的是( )
2MgO+C,下列關于該反應的判斷正確的是( )
A.Mg元素化合價由0價升高到+2價,所以MgO是還原產物
B.由此反應可以判斷氧化性CO2>MgO,還原性Mg>C
C.CO2作氧化劑,表現氧化性,發生氧化反應
D.Mg原子得到的電子數目等于碳原子失去的電子數目
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏伽德羅常數的值。下列說法正確的是
A.由H218O與D216O組成的2.0g物質中所含中子、電子數均為NA
B.0.1molFe分別與足量的鹽酸和氯氣反應,轉移的電子數均為0.2NA
C.0.1molAl與足量NaOH溶液反應,生成氫分子數為0.3NA
D.25℃,將0.1molCH3COONa加入稀醋酸至溶液呈中性時,溶液中CH3COO-數小于0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學實驗中若使某步中的有害產物作為另一步的反應物,形成一個循環,則可不再向環境排放該種有害物質。在如圖所示有編號的反應中,屬于氧化還原反應的有
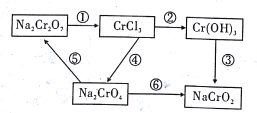
A. 3個 B. 4個 C. 5個 D. 6個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按照如圖所示裝置進行實驗,填寫有關現象及化學方程式。
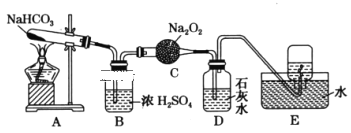
(1)A中現象是___。
(2)B中濃硫酸的作用是___。
(3)C中發生反應的化學方程式為___。
(4)D中的現象是___,發生反應的離子方程式是___。
(5)E中收集的氣體是___(填名稱)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,電子轉移發生在不同物質的同種元素之間的是
A.2H2S + SO2=3S↓ + 2H2O
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
D.CuO + H2SO4=CuSO4 + H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗的選項正確的是 ( )
A.  X若為苯,可用于吸收NH3或HCl,并防止倒吸
X若為苯,可用于吸收NH3或HCl,并防止倒吸
B. 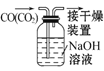 除去CO中的CO2
除去CO中的CO2
C.  可用于分離C2H5OH和H2O的混合物
可用于分離C2H5OH和H2O的混合物
D. 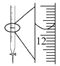 記錄滴定終點讀數為12.20 mL
記錄滴定終點讀數為12.20 mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酚類有機物A是重要的有機化工原料,主要用于生產聚碳酸酯、聚砜樹脂、聚苯醚樹脂等多種高分子材料。下列關于有機物A的說法正確的是( )
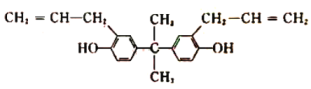
A. 該化合物屬于芳香烴
B. 1mol A最多可與8mol H2發生加成反應
C. A不能與NaOH溶液反應,但能使酸性KMnO4溶液褪色
D. 1mol A最多可與2molBr2發生反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com