
【題目】四種短周期主族元素W,X,Y,Z的原子序數依次增大,W,X的簡單離子具有相同電子層結構,X的原子半徑是短周期主族元素原子中最大的,W與Y同族,Z與X形成的離子化合物的水溶液呈中性.下列說法正確的是( )
A.簡單離子半徑:W<X<Z
B.W與X形成的化合物溶于水后溶液呈堿性
C.氣態氫化物的熱穩定性:W<Y
D.最高價氧化物的水化物的酸性:Y>Z
【答案】B
【解析】解:四種短周期主族元素W、X、Y、Z的原子序數依次增大,X的原子半徑是短周期主族元素原子中最大的,則X是鈉;Z與X形成的離子化合物的水溶液呈中性,說明這種鹽不水解,Z只能是第三周期的非金屬元素,且Z的氫化物的水溶液屬于強酸,則Z是氯;W、X的簡單離子具有相同電子層結構,則W在第二周期且是非金屬元素,可能是氮和氧;W與Y同族,
Y在X與Z之間,位置關系如圖: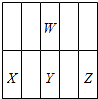 ,
,
A.X、W離子的電子層為2層,Z離子即氯離子電子層為3層,電子層多半徑大,電子層結構相同時,序小半徑反而大,
則簡單離子半徑大小順序是:X<W<Z,故A錯誤;
B.W在第二周期且是非金屬元素,可能是氮和氧,與鈉形成的化合物可能是氮化鈉,氧化鈉,過氧化鈉,它們與水反應都能生成氫氧化鈉使溶液呈堿性,故B正確;
C.W與Y處于同于主族,從上到下,非金屬性逐漸減弱,氣態氫化物的熱穩定性逐漸減弱,則W>Y,故C錯誤;
D.Y與Z處于同同期,從左到右,非金屬性逐漸增強,最高價氧化物的水化物的酸性逐漸增強,則Z>Y,故D錯誤;
故選:B.
四種短周期主族元素W、X、Y、Z的原子序數依次增大,X的原子半徑是短周期主族元素原子中最大的,則X是鈉;Z與X形成的離子化合物的水溶液呈中性,說明這種鹽不水解,Z只能是第三周期的非金屬元素,且Z的氫化物的水溶液屬于強酸,則Z是氯;W、X的簡單離子具有相同電子層結構,則W在第二周期且是非金屬元素,可能是氮和氧;W與Y同族,
Y在X與Z之間,位置關系如圖: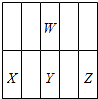 ,
,
據此解答.


科目:高中化學 來源: 題型:
【題目】下列說法或有關化學用語的表達正確的是( )
A.在基態多電子原子中,p軌道電子能量一定高于s軌道電子能量
B.基態Fe原子的外圍電子排布圖為: ![]()
C.因氧元素電負性比氮元素大,故氧原子第一電離能比氮原子第一電離能大
D.根據原子核外電子排布的特點,Cu在周期表中屬于s區元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于乙醇和乙酸的說法錯誤的是
A. 乙醇和乙酸都是常用調味品的主要成分
B. 相同條件下與金屬鈉反應的速率,乙醇比乙酸慢
C. 醫用酒精屬于混合物,醋酸是一元弱酸
D. 由于乙醇的密度比水小,所以乙醇中的水可以通過分液的方法除去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D,其有關性質或結構信息如表所示.
元素 | A | B | C | D |
有關性質或結構信息 | 能形成+7價的化合物 | 基態原子核外s能級上的電子數是p能級上的電子數的2倍 | 該元素形成的單質通常有兩種同素異形體,其中一種單質分布在高空,起著阻止紫外輻射的作用 | 通常情況下能形成短周期中最穩定的雙原分子分子 |
(1)B位于元素周期表中第周期第族,元素B和元素C相比,電負性較小的是(寫元素名稱).化合物BC2晶體與B的單質晶體屬(填同一類型或不同類型).
(2)寫出元素C的含有10個中子的一種核素符號 , B的一種氫化物B2H2分子中σ鍵與π鍵的數目之比為 .
(3)C與D可以組成多種形式的化合物.其中D2C5能勾水反應生成物質X.寫出物質X的稀溶液與過景的Fe反應的離子方程式:
(4)A的最髙價氧化物為無色液體,9.15g該物質與足跫的水混合,得到一種稀溶液,并放出QKJ熱量,該反應的熱化學反應方程式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵、銅單質及其化合物應用范圍很廣.現有含氯化亞鐵雜質的氯化銅晶體(CuCl22H20),為制取純凈的CuCl22H20,首先將其制成水溶液,然后按如圖步驟進行提純: 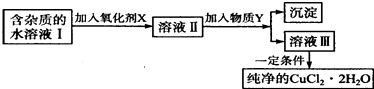
已知Cu2+、Fe3+和Fe2+的氫氧化物開始沉淀和沉淀完全時的pH,見表:
Fe3+ | Fe2+ | Cu2+ | |
氫氧化物開始沉淀時的PH | 1.9 | 7.0 | 4.7 |
氫氧化物完全沉淀時的PH | 3.2 | 9.0 | 6.7 |
請回答下列問題.
(1)最適合作氧化劑X的是 .
A.K2Cr207
B.NaCl0
C.H202
D.KMn04
(2)加入的物質Y是 .
A.CuO
B.NaOH
C.Cu2(OH)2CO3
D.NH3
(3)由溶液Ⅲ獲得CuCl22H2O,需要經過、、過濾操作.
(4)測定溶液Ⅰ中Fe2+的濃度,可用KMnO4標準溶液滴定,取用KMnO4溶液應使用(“酸式”或“堿式”)滴定管.反應的化學方程式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在“綠色化學”工藝中,理想的狀態是反應物中的原子全部轉化為期望的最終產物,即原子的利用率為100%,下列反應類型中能體現“原子經濟性”原則的是
①置換反應 ②化合反應 ③分解反應 ④加成反應 ⑤取代反應 ⑥加聚反應
A. ①②⑤ B. ②⑤⑥ C. ②④⑥ D. 只有⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、磷及其化合物在生產、生活中有重要的用途。回答下列問題:
(1)在堿性條件下,次磷酸鹽可用于化學鍍銀,完成其反應的離子方程式:______。
H2PO2-+Ag+ =PO43-+Ag+ 。
由工業白磷(含少量砷、鐵、鎂等)制備髙純白磷(熔點44℃,沸點280℃),主要生產流程如下:

(2)關于除砷條件的說法合理的是_______(填字母)。
a. 75℃使白磷熔化,并溶于水 b.硝酸濃度不易過大,防止白磷反應
c.溫度不宜過高,防止硝酸分解 d.適當提高溫度,加快化學反應速率
(3)硝酸氧化除砷時被還原為NO,氧化相同質量的砷,當轉化為亞砷酸的量越多,消耗硝酸的量越____(填“多”或“少”)。
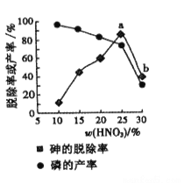
(4)某條件下,用一定量的硝酸處理一定量的工業白磷,砷的脫除率及磷的產率隨硝酸質量分數的變化如圖,砷的脫除率從a點到b點降低的原因是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(多選)設NA為阿伏伽德羅常數的值,下列敘述正確的是( )
A.3mol單質Fe完全轉變為Fe3O4 , 失去8NA個電子
B.常溫常壓下,46gNO2和N2O4的混合氣體中含有的原子總數為3NA
C.78gNa2S和Na2O2的混合物中陽離子和陰離子的總數為3.5NA
D.標準狀況下,2.24 L乙炔中含有共價鍵數目為0.5 NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com