
| 弱酸化學式 | HClO | H2CO3 |
| 電離平衡常數 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
 2OH-+Cl2↑+H2↑,當陰極產生標準狀況下11.2mL氣體,即生成0.0005mol氫氣,則生成NaOH0.001mol,c(OH-)=
2OH-+Cl2↑+H2↑,當陰極產生標準狀況下11.2mL氣體,即生成0.0005mol氫氣,則生成NaOH0.001mol,c(OH-)=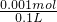 =0.01mol/L,則pH=12,
=0.01mol/L,則pH=12, 2OH-+Cl2↑+H2↑;12;
2OH-+Cl2↑+H2↑;12; 2HCl+O2↑,ClO-與Cl-在酸性條件下發生氧化還原反應生成,離子方程式為ClO-+Cl-+2H+═Cl2↑+H2O,
2HCl+O2↑,ClO-與Cl-在酸性條件下發生氧化還原反應生成,離子方程式為ClO-+Cl-+2H+═Cl2↑+H2O, 2HCl+O2↑;ClO-+Cl-+2H+═Cl2↑+H2O;
2HCl+O2↑;ClO-+Cl-+2H+═Cl2↑+H2O; 2OH-+Cl2↑+H2↑,當陰極產生標準狀況下11.2mL氣體,即生成0.0005mol氫氣,根據方程式計算生成NaOH的物質的量,進而計算溶液的pH;
2OH-+Cl2↑+H2↑,當陰極產生標準狀況下11.2mL氣體,即生成0.0005mol氫氣,根據方程式計算生成NaOH的物質的量,進而計算溶液的pH;

科目:高中化學 來源: 題型:閱讀理解

| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
+ 2 |
- 6 |
+ 2 |
- 6 |
+ 4 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 運用化學反應原理研究氮、氯、碘等單質及其化合物的反應有重要意義.
運用化學反應原理研究氮、氯、碘等單質及其化合物的反應有重要意義.
| ||
| (一定條件) |
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 10-7y |
| x-y |
| 10-7y |
| x-y |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com