
【題目】氯元素是最重要的“成鹽元素”,廣泛存在于自然界的多種礦物中。
(1)氯的原子結構示意圖為______ 。根據氯的原子結構示意圖可得出氯的哪些性質 (寫出一條)_______ 。
(2)氫氣能在氯氣中燃燒,觀察到的現象為___________ 。
(3)氯氣是有毒氣體,貯氯罐發生泄漏時可向貯氯罐周圍的空氣中噴灑稀NaOH溶液。氯氣與NaOH反應的化學方程式為____________ 。
(4)水玻璃(硅酸鈉的水溶液)中滴入稀鹽酸,可生產硅酸膠體,反應的離子方程式為_________。
【答案】 強氧化性 氫氣在氯氣中安靜地燃燒,發出蒼白色火焰,瓶口出現白霧 Cl2+2NaOH=NaCl+NaClO+H2O SiO32-+2H+=H2SiO3(膠體)
強氧化性 氫氣在氯氣中安靜地燃燒,發出蒼白色火焰,瓶口出現白霧 Cl2+2NaOH=NaCl+NaClO+H2O SiO32-+2H+=H2SiO3(膠體)
【解析】
(1)氯原子核內有17個質子,核外有17個電子,分三層排布,其原子結構示意圖為 。氯原子最外層有7個電子,在化學反應中容易得到1個電子達到8電子穩定結構,體現強氧化性。
。氯原子最外層有7個電子,在化學反應中容易得到1個電子達到8電子穩定結構,體現強氧化性。
(2)氫氣能在氯氣中安靜地燃燒,發出蒼白色火焰,生成的HCl極易溶于水,和空氣中的水蒸氣結合成鹽酸小液滴,在瓶口能觀察到白霧。
(3)氯氣可以與NaOH反應從而消除氯氣的污染,反應的化學方程式為Cl2+2NaOH=NaCl+NaClO+H2O。
(4)水玻璃(硅酸鈉的水溶液)中滴入稀鹽酸,發生復分解反應,生成硅酸膠體,反應的離子方程式為SiO32-+2H+=H2SiO3(膠體)。


科目:高中化學 來源: 題型:
【題目】化學反應A2+B2===2AB的能量變化如圖所示,則下列說法正確的是( )
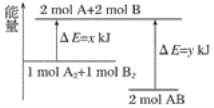
A. 該反應是吸收能量的反應
B. 1molA—A鍵和1molB—B鍵斷裂能放出xkJ的能量
C. 2molA—B鍵斷裂需要吸收ykJ的能量
D. 2molAB的總能量高于1molA2和1molB2的總能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在4℃時向100mL水中溶解了22.4LHCl氣體(標準狀況下測得)后形成的溶液。下列說法中正確的是( )
A. 該溶液物質的量濃度為10mol·L-1
B. 該溶液物質的量濃度因溶液的密度未知而無法求得
C. 該溶液中溶質的質量分數因溶液的密度未知而無法求得
D. 所得溶液的體積為22.5L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校學生課外活動小組的同學設計如圖所示實驗裝置,用來驗證一氧化碳具有還原性,回答下列問題:(提示:C+CO2![]() 2CO C+H2O(g)
2CO C+H2O(g)![]() CO+H2)
CO+H2)

(1)寫出裝置A中所發生反應的離子方程式:____________。
(2)裝置B中最適宜的試劑是________________。
(3)若實驗中沒有裝置C,使裝置B與裝置D直接相連,會對實驗造成的影響是________。
(4)按照如圖裝置進行實驗時,首先進行的操作是__________。
(5)根據實驗中的___________現象,可證明CO具有還原性,有關反應的化學方程式是:__________。
(6)若要根據裝置F中澄清石灰水變渾濁的現象確認一氧化碳具有還原性,應在圖中裝置_____與________之間連接圖中的________裝置(填序號)。
①![]() NaHCO3溶液 ②
NaHCO3溶液 ② 堿石灰 ③
堿石灰 ③![]() NaOH溶液 ④
NaOH溶液 ④![]() 濃H2SO4
濃H2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列裝置圖回答問題(裝置圖用符號表示):

(1)雙氧水(H2O2)是無色液體,可發生如下化學反應:![]() 。反應中MnO2的作用是________。在實驗室利用此反應制取氧氣時,應選用的氣體發生裝置是________,簡述檢查本裝置氣密性的方法:______________________________________________。
。反應中MnO2的作用是________。在實驗室利用此反應制取氧氣時,應選用的氣體發生裝置是________,簡述檢查本裝置氣密性的方法:______________________________________________。
(2)KClO3在MnO2作催化劑時,加熱也可以制得氧氣。應選用的氣體發生裝置是________。
(3)為了驗證MnO2在KClO3分解過程中起到了催化劑作用,我們要把反應后的產物分離,提取出MnO2并驗證其的確是催化劑。分離出MnO2的操作有________、________、洗滌、烘干、稱量。為證明MnO2是催化劑,還需要知道的一個數據是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究表明CO與N2O在Fe+作用下發生反應的能量變化及反應歷程如圖所示,兩步反應分別為:①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。下列說法正確的是

A.反應①是氧化還原反應,反應②是非氧化還原反應
B.Fe+使反應的活化能減小,FeO+是中間產物
C.兩步反應均為放熱反應,總反應的化學反應速率由反應②決定
D.若轉移lmol電子,則消耗1molN2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】密閉容器中進行的可逆反應:aA(g)+bB(g)![]() cC(g)在不同溫度(T1和T2)及壓強(p1和p2)下,混合氣體中B的質量分數w(B)與反應時間(t)的關系如圖所示。下列判斷正確的是
cC(g)在不同溫度(T1和T2)及壓強(p1和p2)下,混合氣體中B的質量分數w(B)與反應時間(t)的關系如圖所示。下列判斷正確的是

A.T1<T2,p1<p2,a+b>c,正反應為吸熱反應
B.T1>T2,p1<p2,a+b<c,正反應為吸熱反應
C.T1<T2,p1>p2,a+b<c,正反應為吸熱反應
D.T1>T2,p1>p2,a+b>c,正反應為放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知反應 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1mol HI(g)分子中化學鍵斷裂時需吸收的能量為_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1mol HI(g)分子中化學鍵斷裂時需吸收的能量為_________kJ。
(2)Bodensteins 研究了下列反應:2HI(g) ![]() H2(g)+I2(g)在 716 K 時,氣體混合物中碘化氫的物質的量分數 x(HI)與反應時間 t 的關系如下表:
H2(g)+I2(g)在 716 K 時,氣體混合物中碘化氫的物質的量分數 x(HI)與反應時間 t 的關系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根據上述實驗結果,該反應的平衡常數K的計算式為__________。
②上述反應中,正反應速率為v正=k正x2(HI),逆反應速率為v逆=k逆x(H2)x(I2),其中k正、k逆為速率常數,則k逆為__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 時,v正=_________ min-1。
③由上述實驗數據計算得到v正~x(HI)和 v逆~x(H2)的關系如圖所示。當升高到某一溫度時,反應重新達到平衡,相應的點依次為__________(填字母)和__________(填字母)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組設計蔗糖與濃硫酸反應的實驗裝置如下,并進行系列實驗(必要時可對甲適當加熱)。下列說法中正確的是

A.可觀察到棉球a、b都褪色,且褪色的原理相同
B.丙、丁中都能觀察到有白色沉淀生成
C.實驗過程中觀察到的系列現象,可驗證濃硫酸具有吸水性、脫水性和氧化性
D.m管的作用是平衡壓強,戊的作用是吸收尾氣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com