
【題目】某同學在學習元素化合物知識的過程中,發現研究物質A可以通過以下的角度展開。其中A、B、C、D、E中均含甲元素。

請回答:
(1)若甲元素為短周期元素,單質D為黃色固體,A是氧化物。
① 甲元素在元素周期表中的位置是______。
② 氧化物A與少量NaOH溶液反應的離子方程式是______。
(2)若D為金屬,A為鹽,產物B遇KSCN溶液呈紅色。
①下列說法正確的是______(填字母)。
a.單質D可以與足量鹽酸、硝酸或硫酸等酸反應生成鹽A
b.鹽A與NaOH溶液反應時,產物在空氣中不穩定,易被O2氧化
c.還原劑Y可選擇銅
②若氧化劑X為酸性高錳酸鉀溶液,5.6 g 單質D全部轉化為產物B時,轉移電子的物質的量為______mol。
【答案】 第三周期第ⅥA族 SO2+ OH- ![]() HSO3- b 0.3
HSO3- b 0.3
【解析】根據A、B、C、D、E中均含甲元素,結合物質的性質和轉化關系圖解答。
(1)若甲元素為短周期元素,單質D為黃色固體,因此D是S,A是氧化物,A是二氧化硫,則
①硫元素的原子序數是16,在元素周期表中的位置是第三周期第ⅥA族。
②二氧化硫與少量NaOH溶液反應生成亞硫酸氫鈉,反應的離子方程式是SO2+OH-=HSO3-。
(2)若D為金屬,A為鹽,產物B遇KSCN溶液呈紅色,B中含有鐵離子,所以D是鐵,A是亞鐵鹽,B是鐵鹽。則
①a.鐵與足量硝酸反應生成硝酸鐵,得不到硝酸亞鐵,a錯誤;b.亞鐵鹽與NaOH溶液反應時,生成的氫氧化亞鐵在空氣中不穩定,易被O2氧化生成氫氧化鐵,b正確;c.金屬性鐵強于銅,銅不能置換出鐵,還原劑Y不能選擇銅,c錯誤。答案選b;
②若氧化劑X為酸性高錳酸鉀溶液,5.6 g 單質鐵的物質的量是0.1mol,全部轉化為產物B時,鐵元素化合價從0價升高到+3價,轉移電子的物質的量為0.3mol。


 仁愛英語同步練習冊系列答案
仁愛英語同步練習冊系列答案 學習實踐園地系列答案
學習實踐園地系列答案科目:高中化學 來源: 題型:
【題目】NOx在陽光的作用下會引起光化學煙霧,從而造成嚴重的大氣污染。火力發電廠煙氣中含有大量氮氧化物,必須對燃燒后的煙氣進行處理,其原理如下(已知:燃燒系統排放煙氣中的NOx,90%以上是NO):
![]()
請回答:
(1)NO2氣體的顏色為______。
(2)下列物質可作試劑A的是______(填字母)。
a.O3 b.CO c.NH3 d.ClO2
(3)試劑B可使用Na2SO3溶液,該反應的化學方程式為______。
(4)NO2還可以用NaOH溶液吸收(原理:2NO2+2NaOH===NaNO2+NaNO3+H2O)。取一定量 NO2用過量的V1 mL c1 mol·L1NaOH溶液吸收完全,剩余NaOH用V2 mL c2 mol·L1 H2SO4溶液恰好中和,則被吸收的NO2物質的量是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉(Na2S2O3)是環保部門監測有害氣體常用的一種藥品,它易溶于水,遇酸易分解。某實驗室模擬工業硫化堿法制取硫代硫酸鈉,其反應裝置及所需試劑如圖。

實驗具體操作步驟為:
①打開分液漏斗使硫酸慢慢滴下,適當調節分液漏斗的滴速,使反應產生的SO2氣體較均勻的通入Na2S和Na2CO3的混合溶液中,同時開啟電動攪拌器攪動,水浴加熱,微沸。
②直至析出的渾濁不再消失,并控制溶液的pH接近7時,停止通入SO2氣體。
(1)寫出儀器A的名稱____。
(2)寫出A中發生反應的化學方程式____。
(3)為了保證硫代硫酸鈉的產量,實驗中通入的SO2不能過量,原因是____。
(4)Na2S2O3常用作脫氯劑,在溶液中易被Cl2氧化成SO42離子,該反應的離子方程式為____。
(5) 為了驗證固體硫代硫酸鈉工業產品中含有碳酸鈉,選用下圖裝置進行實驗。

①實驗裝置的連接順序依次是____(填裝置的字母代號),裝置C中的試劑為____。
②能證明固體中含有碳酸鈉的實驗現象是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯可用于合成殺除根瘤線蟲的農藥(分子式為C3H5Br2Cl)和應用廣泛的DAP樹脂: 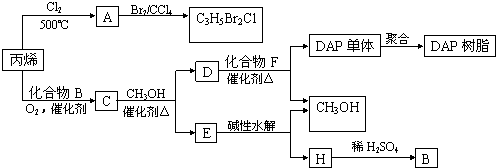
已知酯與醇可發生如下酯交換反應:
RCOOR′+R″OH ![]() RCOOR″+R′OH (R、R′、R″代表烴基)
RCOOR″+R′OH (R、R′、R″代表烴基)
(1)農藥分子C3H5Br2Cl中每個碳原子上均連有鹵原子. ①A的結構簡式是 , A含有的官能團名稱是;
②由丙烯生成A的反應類型是 .
(2)A水解可得到D,該水解反應的化學方程式是 .
(3)C蒸氣密度是相同狀態下甲烷密度的6.25倍,C中各元素的質量分數分別為:碳60%,氫8%,氧32%.C的結構簡式是 .
(4)下列說法正確的是(選填序號字母) . a.C能發生聚合反應、還原反應和氧化反應
b.C含有2個甲基的羧酸類同分異構體有4個
c.D催化加氫的產物與B具有相同的相對分子質量
d.E具有芳香氣味,易溶于乙醇
(5)E的水解產物經分離最終得到甲醇和B,二者均可循環利用于DAP樹脂的制備.其中將甲醇與H分離的操作方法是 .
(6)F的分子式為C10H10O4 . DAP單體為苯的二元取代物,且兩個取代基不處于對位,該單體苯環上的一溴取代物只有兩種.D和F反應生成DAP單體的化學方程式是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】營養均衡是人體健康的保證. ①在糖類、油脂、蛋白質、維生素這四種營養素中,不能為人的生命活動提供能量的有 . 蛋白質在人體內水解的最終產物是氨基酸,氨基酸的結構可表示為R﹣CH(NH2)﹣X,則X的名稱為 .
②某種食品外包裝上的配料標簽如圖所示.配料中具有防腐作用.碳酸氫鈉受熱易分解,產生的氣體可以使食品疏松,碳酸氫鈉受熱分解的化學方程式為 . 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)利用反應![]() 可制備CuSO4溶液,且反應簡便無污染,若將該反應設計為原電池,其正極電極反應式為_____________________。
可制備CuSO4溶液,且反應簡便無污染,若將該反應設計為原電池,其正極電極反應式為_____________________。
(2)工業上由黃銅礦(主要成分CuFeS2)冶煉銅的過程中會產生二氧化硫氣體和固體熔渣混合物,用稀H2SO4浸泡熔渣,取少量所得溶液,滴加KSCN溶液后呈紅色,說明溶液中存在Fe3+,檢驗溶液中是否存在Fe2+的最好的方法是_________________________(用化學反應方程式或離子方程式說明)。
(3)以CuSO4溶液為電解質溶液進行粗銅(含Al、Zn、Ag、Pt、Au等雜質)的電解精煉,下列說法正確的是_______________。
a.電能全部轉化為化學能 b.粗銅接電源正極,發生氧化反應
c.溶液中Cu2+向陽極移動 d.利用陽極泥可回收Ag、Pt、Au等金屬
(4)用惰性電極電解CuSO4溶液,若只有陽極產生氣體,則所得溶液的pH_______(填變大、變小、不變,不考慮溶液體積變化),要使電解質溶液恢復到電解前的狀態,可加入____________;若陰陽兩極均有氣體生成,要使電解質恢復到電解前的狀態,可加入__________,當加入該物質1mol即恢復到電解前狀態,則電解時電路中轉移電子的物質的量為__________摩爾。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用。如圖所示是用石墨和鐵作電極電解飽和食鹽水的裝置,請填空:
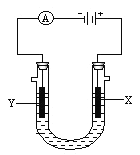
(1)X的電極名稱是__________極,發生的電極反應為____________________________;
(2)Y極的電極材料是_________,檢驗X極產物的方法是_________________________。
(3)某同學在實驗時誤將兩種電極材料接反,導致X極上未收集到預期產物,一段時間后又將兩極的連接方式糾正過來,發現X極附近出現了白色沉淀,此沉淀是__________(填化學式),其形成原因是_______________________________________,該沉淀在空氣中放置,現象是_____________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com