
【題目】下列有關的離子方程式書寫正確的是
A. 向銅片中滴加濃硫酸并加熱,有刺激性氣味氣體產生:Cu+4H++SO42-![]() Cu2++SO2↑+2H2O
Cu2++SO2↑+2H2O
B. 過量鐵粉在加熱條件下與濃硝酸反應:Fe+ NO3-+4H+ =Fe3++NO2↑+2H2O
C. 20mL1.0mol/L的明礬溶液與10mL3.5mol/LBa(OH)2溶液混合充分反應:3Ba2++6OH-+2Al3++3SO42-=3BaSO4+2Al(OH)3↓
D. 向Ca(HCO3)2溶液中加入過量NaOH溶液,有白色沉淀生成:Ca2++2HCO3- +2OH-== CaCO3↓+2H2O+CO32-
【答案】D
【解析】A. 濃硫酸寫化學式,故A錯誤;B. 過量鐵粉在加熱條件下與濃硝酸反應生成硝酸亞鐵,而且要符合元素守恒和電子守恒:Fe+2NO3-+4H+ =Fe2++2NO2↑+2H2O,故B錯誤;C. 20mL1.0mol/L的明礬溶液含有20mmolAl3+、40mmolSO42-,10mL3.5mol/LBa(OH)2溶液含有35mmolBa2+、70mmolOH-,混合充分反應:7Ba2++14OH-+4Al3++7SO42-=7BaSO4+2Al(OH)3↓+![]() +4H2O,故C錯誤;D. 向Ca(HCO3)2溶液中加入過量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32-,故D正確。故選D。
+4H2O,故C錯誤;D. 向Ca(HCO3)2溶液中加入過量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32-,故D正確。故選D。


 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源: 題型:
【題目】NaClO2的漂白能力是漂白粉的45倍。NaClO2廣泛用于造紙工業、污水處理等。工業上生產NaClO2的工藝流程如下:

(1)ClO2發生器中的反應為2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。實際工業生產中可用硫黃、濃硫酸代替反應原料中的SO2,其原因是_________________(用化學方程式表示)。
(2)反應結束后,向ClO2發生器中通入一定量空氣的目的是_________________。
(3)吸收器中生成NaClO2反應的離子方程式為_________________,吸收器中的反應溫度不能過高,可能的原因為_________________。
(4)某化學興趣小組用如下圖所示裝置制備SO2并探究SO2與Na2O2的反應。

①為除去過量的SO2,C中盛放的試劑為___________。
②D中收集到的氣體可使帶余燼的木條復燃,B中硬質玻璃管內肯定發生反應的化學方程式為_________________。
③有同學認為B中硬質玻璃管內可能還有Na2SO4生成。為檢驗是否有Na2SO4生成,他們設計了如下方案:

同學們經過討論,認為上述方案不合理,其理由是:a.____________;b.____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上從鋁土礦(主要成分是Al2O3還含有SiO2、Fe203等雜質)中提取鋁可采用如圖工藝流程(反應條件已經省略):

請回答下列問題:
(1)圖中I、Ⅱ、Ⅲ步驟中涉及分離溶液與沉淀的實驗方法是___________(填操作名稱)。
(2)Al2O3是兩性氧化物,SiO2是酸性氧化物,Fe2O3是堿性氧化物,根據它們的性質,判斷固體B的成分是__________(填化學式)。
(3)Fe2O3和鹽酸反應的化學方程式為______________,沉淀C的化學式是__________。
(4)如果溶液D中通入“過量CO2”,改成通入“過量HCl”可以嗎? 為什么? ____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一體積不變的密閉容器中充入2mol A、0.6mol C和一定量的B三種氣體,一定條件下發生反應2A(g)+B(g)3c(g),各物質的濃度隨時間變化的關系如圖1所示,其中如t0~t1階段c(B)未畫出.圖2為反應體系中反應速率隨時間變化的情況,且t2、t3、t4各改變一種不同的條件. 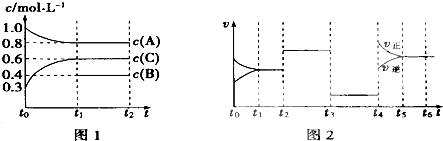
(1)若t1=15min,則t0~t1階段以c的濃度變化表示的反應速率V(C)= .
(2)t3時改變的條件為 , B的起始物質的量為 .
(3)t4~t5階段,若A的物質的量減少了O.01mol,而此階段中反應體系吸收能量為a kJ,寫出此條件下該反應的熱化學方程式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下列各實驗裝置的敘述中,不正確的是( )
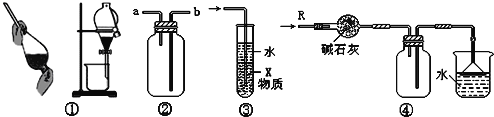
A. 裝置①可用于分離CCl4和H2O的混合物,并且CCl4要從儀器下口放出
B. 裝置②可用于收集H2、NH3、CO2、Cl2、HCl、NO等氣體
C. 裝置③中X若為CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 裝置④可用于干燥、收集HCl,并吸收多余的HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氮是造成水體富營養化的重要因素之一,用次氯酸鈉水解生成的次氯酸將水中的氨氮(用NH3表示)轉化為氮氣除去,相關反應如下:
① NH3 +HClO===NH2Cl+H2O ② NH2Cl+HClO===NHCl2+H2O ③ 2NHCl2 +H2O===N2+HClO+3HCl
已知在水溶液中NH2Cl較穩定,NHCl2不穩定易轉化為氮氣。在其他條件一定的情況下,改變![]() (即NaClO溶液的投入量),溶液中次氯酸鈉去除氨氮效果與余氯(溶液中+1價氯元素的含量)影響如右圖所示。則下列說法正確的是
(即NaClO溶液的投入量),溶液中次氯酸鈉去除氨氮效果與余氯(溶液中+1價氯元素的含量)影響如右圖所示。則下列說法正確的是

A. 次氯酸與氨的總反應可表示為:2NH3+3HClO===N2+3H2O+3HCl
B. 反應中氨氮去除效果最佳的n(NaClO)/n(NH3)值約為1.5
C. a點之前溶液中發生的主要反應為:NH2Cl+HClO===NHCl2+H2O
D. 次氯酸鈉溶液pH較小時有O2生成,促使氨氮去除率提高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有以下物質①熔融狀態的NaCl ②NH3·H2O ③Na2O固體 ④銅 ⑤BaSO4固體 ⑥酒精 ⑦液態HCl ⑧KNO3溶液,其中屬于電解質的是:___________;該狀態下能導電的是_____________;屬于非電解質的是_________________。(請用序號作答)
(2)以下A~D四個涉及H2O2的反應,請填空:
A. Na2O2+ 2HCl=H2O2+2NaCl B. Ag2O+H2O2=2Ag+O2↑+H2O
C. 2H2O2=2H2O+O2↑ D. □H2O2+□KMnO4+□H2SO4→□MnSO4+□K2SO4+□H2O+□O2↑
①配平D方程式,系數填在方框內____;該反應的還原劑是_________________;
②H2O2既體現氧化性,又體現還原性的反應是________,H2O2既不作氧化劑又不作還原劑的反應是__________。(請用代號作答)
③請用雙線橋法表示B反應中電子轉移的方向和數目:___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從柑桔中可煉制萜二烯( ![]() ),下列有關它的推測不正確的是( )
),下列有關它的推測不正確的是( )
A.分子式為C10H16
B.常溫下呈液態難溶于水
C.所有原子可能共平面
D.與過量溴的CCl4 溶液反應后產物(如圖)為: 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I、化學上常見的混合物分離或提純的基本裝置如下:

(1)寫出儀器名稱:a______,b______________。
(2)從海帶提取碘的操作如下,除特殊說明外,請在空白處填上上圖相應裝置中的序號:將干海帶進行灼燒,海帶灰中含有較多KI,將海帶灰溶于水,然后______得到澄清濾液;向濾液中加入硫酸和H2O2混合溶液,得到棕褐色含有單質碘的水溶液。該反應的離子方程式為:______________。向碘的水溶液中加入適量CCl4,進行______操作將上下兩層溶液分開。將含有碘的CCl4溶液置于蒸餾燒瓶內進行_____操作,可以粗略從CCl4溶液中分離出碘。
Ⅱ、某同學需用480mL0.5mol/LNa2CO3溶液,在實驗室進行配制。
(1)該同學用托盤天平應稱量______gNa2CO3粉末,使用容量瓶前必須進行的一步操作是_____。
(2)下圖是該同學配制過程的一些關鍵步驟和操作圖。

配制過程的先后順序為(用字母A--F填寫)_______。
(3)步驟A通常稱為洗滌,如果沒有步驟A,則配得溶液的濃度將_____(填“偏高”、“偏低”、“不變”);步驟F如果俯視刻度線,配得溶液的濃度將______(填“偏高”、“偏低”、“不變”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com